في الآونة الأخيرة، حظيت الأخبار التي نشرتها صحيفة دان تري ، والتي تفيد بأن وزارة الصحة منحت شهادة تسجيل تداول في فيتنام لدواء مضاد للسرطان يسمى Pemborria، باهتمام خاص من قبل الجمهور.
على وجه التحديد، وفقًا للقرار رقم 628/QD-QLD بتاريخ 31 أكتوبر الصادر عن إدارة الأدوية في فيتنام، وزارة الصحة ، تم منح دواء Pembroria شهادة تسجيل تداول في فيتنام لمدة 3 سنوات.
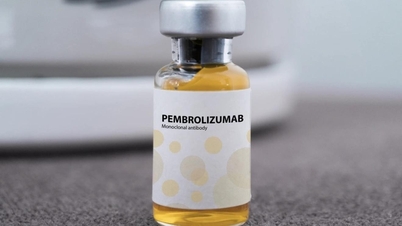
يحتوي دواء Pembroria على المادة الفعالة الرئيسية Pembrolizumab، بتركيز 100 ملغ/4 مل، من إنتاج شركة ذات مسؤولية محدودة "PK-137" (روسيا)، ويتم إعداده على شكل محلول مركّز للتسريب، مع مدة صلاحية تصل إلى 24 شهرًا من تاريخ الصنع.

يحتوي دواء Pembroria على المادة الفعالة الرئيسية Pembrolizumab (الصورة: incentra).
بالإضافة إلى الشكل المذكور أعلاه، ووفقًا للمعلومات الواردة من مرفق تسجيل التداول، يتم تحضير Pemborria أيضًا في شكل محلول شفاف إلى معتم قليلاً، عديم اللون إلى بني فاتح.
ما هي أنواع السرطان التي يستخدم Pembroria لعلاجها؟
وفقًا لتعليمات الاستخدام الصادرة عن وكالة التسجيل، يُستخدم Pembroria لعلاج العديد من أنواع السرطان.
وتشمل هذه الأورام الميلانينية؛ وسرطان الرئة ذو الخلايا غير الصغيرة؛ وسرطان الخلايا الحرشفية في الرأس والرقبة؛ وسرطان الغدد الليمفاوية هودجكين الكلاسيكي؛ وسرطان الخلايا الظهارية؛ وسرطان المريء؛ وسرطان القولون والمستقيم؛ وسرطان غير القولون والمستقيم؛ وسرطان عنق الرحم وسرطان بطانة الرحم؛ وسرطان الخلايا الكلوية؛ وسرطان الثدي الثلاثي السلبي؛ وسرطان الغدة الدرقية في المعدة أو تقاطع المعدة والمريء؛ وسرطان القنوات الصفراوية.
اعتمادًا على نوع السرطان ومرحلة المرض (مبكر أو نقيلي)، سيتم وصف Pembroria في أعمار مختلفة، ويُستخدم كعلاج وحيد أو بالاشتراك مع العلاج الكيميائي وأدوية أخرى.
يُستخدم هذا الدواء في العيادات الخارجية وفي المستشفيات. يجب أن يبدأ العلاج ويشرف عليه أطباء أورام ذوو خبرة.
لوصف الدواء المذكور أعلاه، يجب على المرضى إجراء اختبار PD-L1 (اختبار المناعة الكيميائية لقياس كمية بروتين PD-L1 على سطح الخلايا السرطانية)، واختبار لتحديد حالة الورم من عدم استقرار الميكروساتلايت (MSI) أو نقص إصلاح عدم التطابق (MMR).
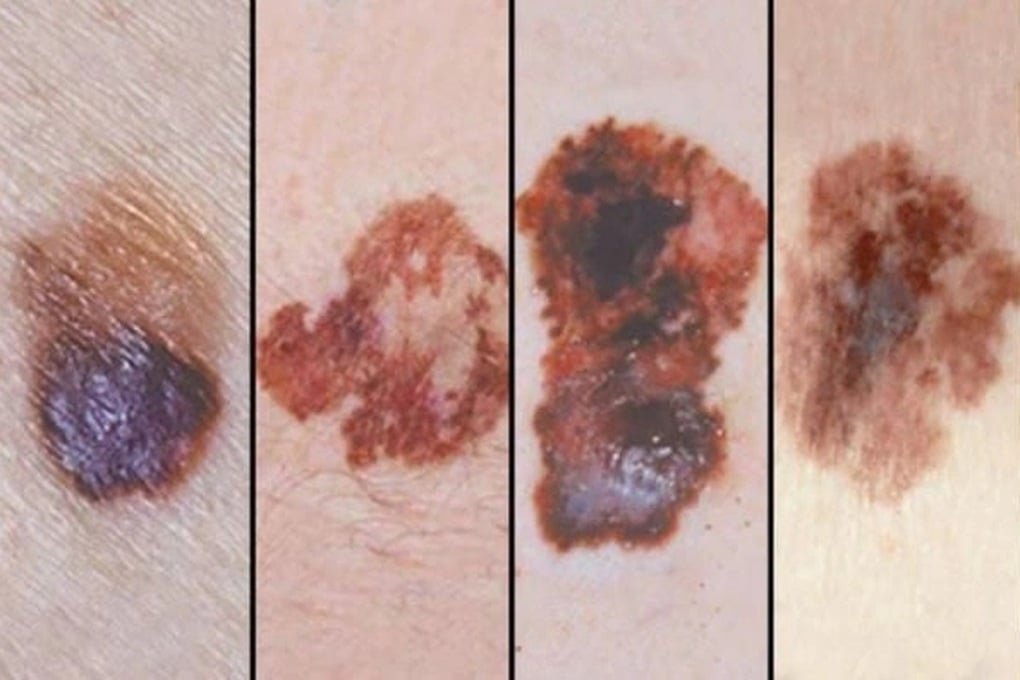
الورم الميلانيني الخبيث هو أحد الأمراض التي يمكن علاجها باستخدام Pembrolizumab (الصورة: BV).
ملاحظات عند الاستخدام
فيما يتعلق بالجرعة، الجرعة الموصى بها من بيمبروليزوماب للبالغين هي 200 ملغ كل 3 أسابيع أو 400 ملغ كل 6 أسابيع، يتم إعطاؤها عن طريق الحقن الوريدي.
الجرعة الموصى بها من Pembrolizumab كعلاج وحيد للمرضى الأطفال الذين تتراوح أعمارهم بين 3 سنوات وما فوق (المصابين بسرطان الغدد الليمفاوية هودجكين الكلاسيكي) أو المرضى الذين تتراوح أعمارهم بين 12 سنة وما فوق (المصابين بسرطان الجلد) هي 2 ملغ / كغ من وزن الجسم (بحد أقصى 200 ملغ) يتم إعطاؤها عن طريق الحقن الوريدي كل 3 أسابيع.
أما فيما يتعلق بالاستخدام المشترك، فسوف يعتمد ذلك على خصائص المنتج والعلاجات المصاحبة.
اعتمادًا على نوع السرطان، يُنصح المرضى بتلقي علاج Pembrolizumab حتى ظهور دليل على تطور المرض أو السمية غير المقبولة.

مرضى السرطان يتلقون العلاج في مستشفى تشو راي (تصوير: هوانغ لي).
في العلاج المساعد لبعض أنواع السرطان (مثل الورم الميلانيني، أو سرطان الرئة ذو الخلايا غير الصغيرة، أو سرطان الخلايا الكلوية)، يوصي المصنعون باستخدام بيمبروليزوماب حتى عودة المرض، أو السمية غير المقبولة، أو لمدة تصل إلى عام واحد...
بالإضافة إلى مؤشرات العلاج، يحتاج المرضى أيضًا إلى الانتباه إلى التفاعلات المناعية الضارة عند استخدام Pembroria لإجراء التعديلات المناسبة، أو التوقف مؤقتًا عن الاستخدام أو التوقف إلى أجل غير مسمى.
على وجه التحديد، قد يعاني المرضى من حالات مثل الالتهاب الرئوي (الدرجة 2-3)، والتهاب القولون (الدرجة 2-3)، والتهاب الكلية، وأمراض الغدد الصماء، والتهاب الكبد، وردود الفعل تحت الجلد الشديدة...
إذا أصيب المريض بالتهاب عضلة القلب، أو التهاب الدماغ، أو متلازمة غيلان باريه (اعتلال الأعصاب الحاد)، أو تفاعلات شديدة بعد الحقن (الدرجة 3-4)، فيجب إيقاف العلاج بهذا الدواء بشكل دائم.
بالإضافة إلى ذلك، لم تُثبت سلامة وفعالية بيمبروليزوماب لدى الأشخاص دون سن 18 عامًا (باستثناء مرضى الأطفال المصابين بسرطان الجلد (الميلانوما) وسرطان الغدد الليمفاوية هودجكين الكلاسيكي). يُنصح أيضًا بإعطاء الدواء وريديًا على مدى 30 دقيقة، وليس عن طريق الحقن الوريدي السريع أو الحقن الوريدي السريع.
منح تسجيل التداول لإجراء البحوث السريرية
في القسم 5، المادة 2 (بشأن مسؤوليات منشأة التصنيع ومنشأة تسجيل الأدوية) من القرار رقم 628/QD-QLD الصادر في 31 أكتوبر، ذكرت إدارة الأدوية في فيتنام، وزارة الصحة أنه مع الدواء رقم 1 في الملحق لهذا القرار (Pembroria)، بعد منح شهادة تسجيل التداول، يجب على الشركة تحديث تقدم تنفيذ الأبحاث السريرية بشكل دوري، ومراقبة المناعة في المرحلة الثالثة وتقديم المستندات لتغيير واستكمال وتحديث بيانات مراقبة المناعة في المرحلة الثالثة عندما تنتهي فترة البحث.
وفقًا لمعلومات إدارة الغذاء والدواء الأمريكية، فإن بيمبروريا جسم مضاد وحيد النسيلة، يُنتج استنادًا إلى المنتج البيولوجي المرجعي الأصلي لشركة الأدوية الأمريكية MSD. منذ عام ٢٠١٧، تم ترخيص كيترودا، وهو دواء آخر يحتوي على المكون النشط الرئيسي بيمبروليزوماب، للتداول في فيتنام.
المصدر: https://dantri.com.vn/suc-khoe/thuoc-pembroria-cua-nga-duoc-chi-dinh-cho-cac-loai-ung-thu-gi-20251111231728560.htm




![[صورة] الطرق السريعة التي تمر عبر دونج ناي](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)





























































































![انتقال دونج ناي إلى OCOP: [المادة 3] ربط السياحة باستهلاك منتجات OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








تعليق (0)