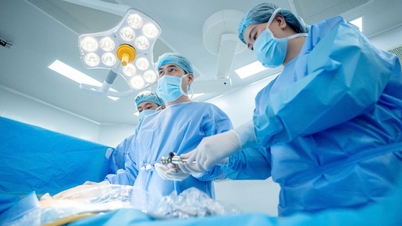
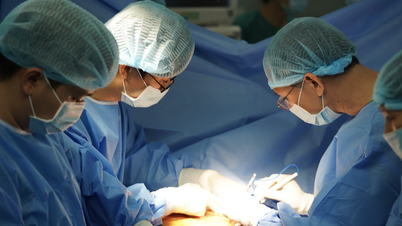
Die vietnamesische Arzneimittelbehörde ( Gesundheitsministerium ) hat in Vietnam die Zulassung für das in Russland hergestellte Medikament Pembroria mit mehr als 14 Indikationen für verschiedene Krebsarten erteilt.
Pembroria (Hauptwirkstoff: Pembrolizumab, 100 mg/4 ml) wird von der Gesellschaft mit beschränkter Haftung „PK-137“ (Russland) hergestellt. Zulassungsstelle: Anabion Pharmaceutical Trading Ltd, Vereinigte Arabische Emirate. Pembroria ist als konzentrierte Infusionslösung erhältlich und ab Herstellungsdatum 24 Monate haltbar. Packungsgröße: 1 Flasche à 4 ml.
Der Wirkstoff Pembrolizumab hat mehr als 14 Indikationen für verschiedene Krebsarten (wie Lungenkarzinom, Melanom, Darmkrebs, Gebärmutterhalskrebs, Nierenzellkarzinom, Brustkrebs...).
In der Entscheidung 628/QD-QLD wird eindeutig festgelegt, dass Arzneimittelherstellungs- und -registrierungseinrichtungen verantwortlich sind für: Die Herstellung und Lieferung von Arzneimitteln nach Vietnam gemäß den beim Gesundheitsministerium registrierten Aufzeichnungen und Dokumenten.
Die für die Arzneimittelregistrierung zuständige Einrichtung ist verpflichtet, dem Gesundheitsministerium über die Einhaltung der Guten Herstellungspraxis (GMP) für Arzneimittel und Wirkstoffe zu berichten. Wird der Herstellungserlaubnis der Einrichtung entzogen oder verstößt sie gegen die GMP-Vorschriften für Arzneimittel und Wirkstoffe im Herkunftsland, muss sie innerhalb von 15 Tagen nach Benachrichtigung durch die zuständige Behörde des Herkunftslandes Bericht erstatten.
Gleichzeitig ist mit Behandlungseinrichtungen und Einrichtungen der Präventivmedizin zusammenzuarbeiten, um die geltenden Vorschriften für verschreibungspflichtige Arzneimittel einzuhalten, die Sicherheit, Wirksamkeit und unerwünschten Wirkungen von Arzneimitteln auf die vietnamesische Bevölkerung zu überwachen und die Ergebnisse gemäß den Vorschriften zusammenzufassen und zu berichten.
Die vietnamesische Arzneimittelbehörde verlangt, dass das Unternehmen nach Erteilung einer Zulassungsbescheinigung für den Arzneimittelverkehr den Fortschritt der klinischen Forschung zur Immunogenitätsüberwachung in Phase III alle drei Monate ab dem Ausstellungsdatum der Zulassungsbescheinigung regelmäßig aktualisiert und Dokumente zur Änderung und Aktualisierung der Daten zur Immunogenitätsüberwachung in Phase III vorlegt, wenn der Forschungszeitraum endet.
Quelle: https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html



![[Foto] Premierminister Pham Minh Chinh empfängt den laotischen Arbeits- und Sozialminister Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)






















































































![Dong Nai OCOP-Übergang: [Artikel 3] Verknüpfung von Tourismus und OCOP-Produktkonsum](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Kommentar (0)