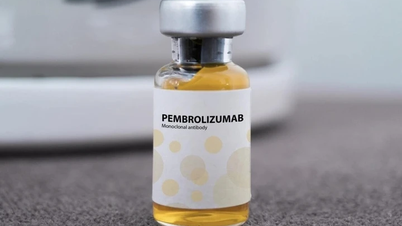
Η Υπηρεσία Φαρμάκων του Βιετνάμ ( Υπουργείο Υγείας ) χορήγησε πιστοποιητικό κυκλοφορίας στο Βιετνάμ για το φάρμακο Pembroria με περισσότερες από 14 ενδείξεις για διαφορετικούς τύπους καρκίνου που παράγεται στη Ρωσία.
Στην οποία, το Pembroria (κύριο δραστικό συστατικό είναι η Pembrolizumab, περιεκτικότητα 100mg/4ml) παράγεται από την Εταιρεία Περιορισμένης Ευθύνης "PK-137" (Ρωσία). Φορέας έγκρισης: Anabion Pharmaceutical Trading Ltd, Ηνωμένα Αραβικά Εμιράτα. Το Pembroria παρασκευάζεται με τη μορφή συμπυκνωμένου διαλύματος για έγχυση, με διάρκεια ζωής 24 μήνες από την ημερομηνία παρασκευής. Συσκευασία: 1 φιάλη x 4ml.
Το δραστικό συστατικό Pembrolizumab έχει περισσότερες από 14 ενδείξεις για διαφορετικούς τύπους καρκίνου (όπως καρκίνωμα του πνεύμονα, μελάνωμα, καρκίνο του παχέος εντέρου, καρκίνο του τραχήλου της μήτρας, νεφρικό καρκίνωμα, καρκίνο του μαστού...).
Η απόφαση 628/QD-QLD ορίζει σαφώς ότι τα ιδρύματα παρασκευής και καταχώρισης φαρμάκων είναι υπεύθυνα για: Την παραγωγή και την προμήθεια φαρμάκων στο Βιετνάμ σύμφωνα με τα αρχεία και τα έγγραφα που έχουν καταχωριστεί στο Υπουργείο Υγείας .
Η μονάδα καταχώρισης φαρμάκων οφείλει να υποβάλλει έκθεση στο Υπουργείο Υγείας σχετικά με τη διατήρηση της συμμόρφωσης με τις ορθές πρακτικές παρασκευής της μονάδας παρασκευής φαρμάκων και συστατικών φαρμάκων. Σε περίπτωση που η άδεια παρασκευής της μονάδας παρασκευής έχει ανακληθεί ή δεν συμμορφώνεται με τις ορθές πρακτικές παρασκευής φαρμάκων και συστατικών φαρμάκων στη χώρα καταγωγής, η μονάδα οφείλει να υποβάλει έκθεση εντός 15 ημερών από την ημερομηνία κοινοποίησης από την αρμόδια υπηρεσία διαχείρισης της χώρας καταγωγής.
Ταυτόχρονα, συντονισμός με κέντρα θεραπείας και προληπτικές ιατρικές εγκαταστάσεις για τη συμμόρφωση με τους ισχύοντες κανονισμούς σχετικά με τα συνταγογραφούμενα φάρμακα, παρακολούθηση της ασφάλειας, της αποτελεσματικότητας και των ανεπιθύμητων ενεργειών των φαρμάκων στους Βιετναμέζους, καθώς και σύνθεση και αναφορά σύμφωνα με τους κανονισμούς.
Η Υπηρεσία Φαρμάκων του Βιετνάμ απαιτεί, μετά τη χορήγηση πιστοποιητικού κυκλοφορίας φαρμάκων, η εταιρεία να ενημερώνει περιοδικά την πρόοδο της κλινικής έρευνας σχετικά με την παρακολούθηση της ανοσογονικότητας φάσης III κάθε 3 μήνες από την ημερομηνία έκδοσης του πιστοποιητικού κυκλοφορίας φαρμάκων και να υποβάλλει έγγραφα για την αλλαγή και ενημέρωση των δεδομένων παρακολούθησης της ανοσογονικότητας φάσης III όταν λήξει η ερευνητική περίοδος.
Πηγή: https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html


![[Φωτογραφία] Αυτοκινητόδρομοι που διέρχονται από το Ντονγκ Νάι](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)


















![[Φωτογραφία] Αυτοκινητόδρομοι που διέρχονται από το Ντονγκ Νάι](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)








































































![Μετάβαση στο Dong Nai OCOP: [Άρθρο 3] Σύνδεση του τουρισμού με την κατανάλωση προϊόντων OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Σχόλιο (0)