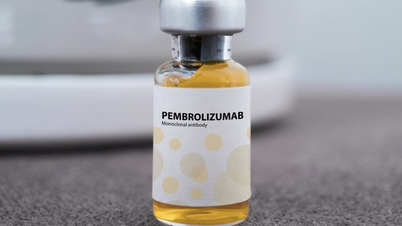
La Administración de Medicamentos de Vietnam ( Ministerio de Salud ) ha otorgado un certificado de registro de circulación en Vietnam para el medicamento Pembroria, producido en Rusia, con más de 14 indicaciones para diferentes tipos de cáncer.
Pembroria (cuyo principio activo principal es pembrolizumab, con una concentración de 100 mg/4 ml) es un producto de la empresa de responsabilidad limitada "PK-137" (Rusia). Registro mercantil: Anabion Pharmaceutical Trading Ltd, Emiratos Árabes Unidos. Pembroria se presenta en forma de solución concentrada para perfusión, con una caducidad de 24 meses a partir de la fecha de fabricación. Presentación: 1 frasco de 4 ml.
El principio activo pembrolizumab tiene más de 14 indicaciones para diferentes tipos de cáncer (como carcinoma de pulmón, melanoma, cáncer colorrectal, cáncer de cuello uterino, carcinoma de células renales, cáncer de mama...).
La Decisión 628/QD-QLD establece claramente que los establecimientos de fabricación y registro de medicamentos son responsables de: Producir y suministrar medicamentos a Vietnam de acuerdo con los registros y documentos registrados ante el Ministerio de Salud .
La entidad encargada del registro de medicamentos debe informar al Ministerio de Salud sobre el cumplimiento de las buenas prácticas de fabricación en la planta de producción de medicamentos e ingredientes farmacéuticos. En caso de que se revoque la licencia de fabricación de la planta o esta incumpla las buenas prácticas de fabricación de medicamentos e ingredientes farmacéuticos en su país de origen, deberá presentar un informe en un plazo de 15 días a partir de la fecha de notificación por parte del organismo regulador competente de dicho país.
Al mismo tiempo, coordinar con los centros de tratamiento y los centros médicos preventivos el cumplimiento de las normas vigentes sobre medicamentos recetados, supervisar la seguridad, la eficacia y los efectos no deseados de los medicamentos en la población vietnamita, y sintetizar e informar de acuerdo con las normas.
La Administración de Medicamentos de Vietnam exige que, una vez concedido el certificado de registro de circulación de medicamentos, la empresa actualice periódicamente el progreso de la investigación clínica sobre el seguimiento de la inmunogenicidad de fase III cada 3 meses a partir de la fecha de emisión del certificado de registro de circulación de medicamentos y presente la documentación necesaria para modificar y actualizar los datos de seguimiento de la inmunogenicidad de fase III cuando finalice el período de investigación.
Fuente: https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html





![[Foto] El primer ministro Pham Minh Chinh recibe al ministro de Trabajo y Bienestar de Laos, Phosay Sayasone.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)







![[Vídeo] Muchos artículos se encuentran en mal estado debido a la lenta puesta en funcionamiento de dos grandes hospitales.](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762906839099_dung00-29-15-18still010-jpg.webp)




![[Vídeo] Chu Nhat Quang: De la "Marca Sagrada" al récord mundial](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762909239247_2385424671828914264-8140-jpg.webp)

![[Vídeo] Los borradores de los documentos del XIV Congreso Nacional destacan el papel clave de las relaciones exteriores.](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762905940110_dung00-24-48-14still009-jpg.webp)



































































![Transición de Dong Nai OCOP: [Artículo 3] Vinculación del turismo con el consumo de productos OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Kommentar (0)