Recientemente, la noticia publicada por el periódico Dan Tri de que el Ministerio de Salud ha otorgado un certificado de registro de circulación en Vietnam para un medicamento contra el cáncer llamado Pembroria ha recibido especial atención por parte del público.
Específicamente, según la Decisión No. 628/QD-QLD de fecha 31 de octubre emitida por la Administración de Medicamentos de Vietnam, Ministerio de Salud , al medicamento Pembroria se le otorga un certificado de registro de circulación en Vietnam con una validez de 3 años.
El medicamento Pembroria tiene como ingrediente activo principal Pembrolizumab, con un contenido de 100 mg/4 ml, producido por la Sociedad de Responsabilidad Limitada "PK-137" (Rusia), preparado en forma de solución concentrada para infusión, con una vida útil de 24 meses a partir de la fecha de fabricación.

El medicamento Pembroria tiene como ingrediente activo principal el pembrolizumab (Foto: incentra).
Además de la forma anterior, según la información del centro de registro de circulación, la Pembroria también se prepara en forma de una solución transparente a ligeramente opaca, de incolora a marrón claro.
¿Para qué tipos de cáncer está indicada Pembroria?
Según las instrucciones de uso de la agencia de registro, Pembroria está indicada para muchos tipos de cáncer.
Estos son: melanoma; cáncer de pulmón de células no pequeñas; carcinoma de células escamosas de cabeza y cuello; linfoma de Hodgkin clásico; cáncer urotelial; cáncer de esófago; cáncer colorrectal; cáncer no colorrectal; cáncer de cuello uterino y endometrio; carcinoma de células renales; cáncer de mama triple negativo; adenocarcinoma de estómago o de la unión gastroesofágica; y colangiocarcinoma.
Dependiendo del tipo de cáncer y de la etapa de la enfermedad (temprana o metastásica), Pembroria se prescribirá a diferentes edades, se utilizará como monoterapia o en combinación con quimioterapia y otros medicamentos.
Este medicamento se utiliza tanto en régimen ambulatorio como hospitalario. El tratamiento debe ser iniciado y supervisado por oncólogos con experiencia.
Para que se les recete el medicamento mencionado anteriormente, los pacientes deben someterse a pruebas de PD-L1 (pruebas de inmunohistoquímica para medir la cantidad de proteína PD-L1 en la superficie de las células cancerosas), pruebas para determinar el estado del tumor en cuanto a inestabilidad de microsatélites (MSI) o deficiencia en la reparación de errores de emparejamiento (MMR).
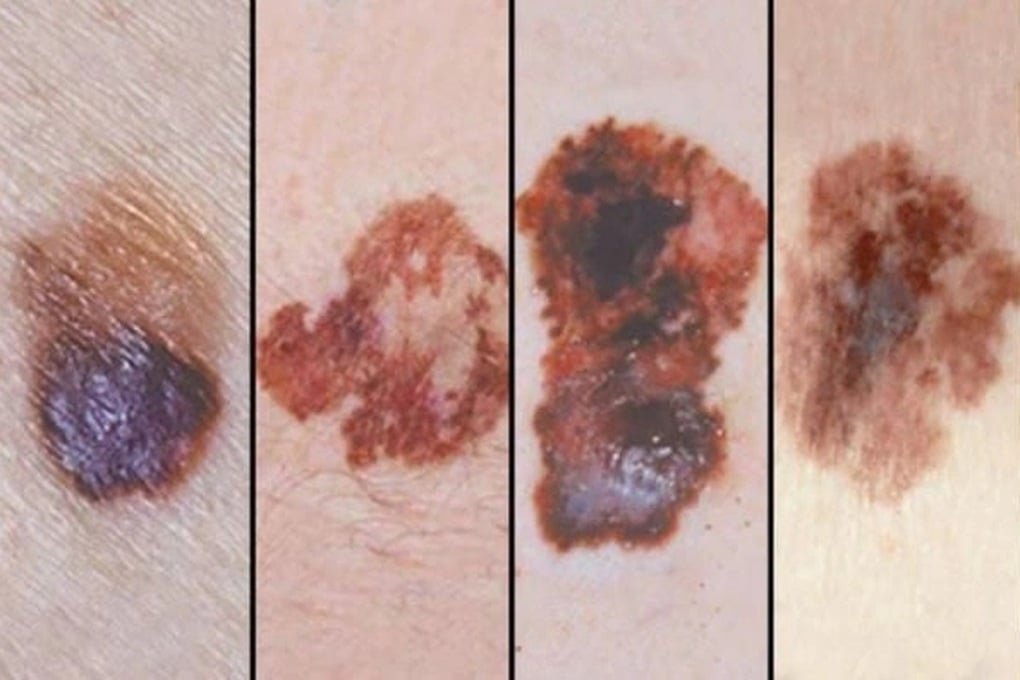
El melanoma maligno es una de las enfermedades que se pueden tratar con pembrolizumab (Foto: BV).
Notas sobre el uso
En cuanto a la dosificación, la dosis recomendada de Pembrolizumab en adultos es de 200 mg cada 3 semanas o 400 mg cada 6 semanas, administrada como infusión intravenosa.
La dosis recomendada de pembrolizumab como monoterapia en pacientes pediátricos de 3 años de edad o mayores (con linfoma de Hodgkin clásico) o pacientes de 12 años de edad o mayores (con melanoma) es de 2 mg/kg de peso corporal (máximo 200 mg) administrada como infusión intravenosa cada 3 semanas.
En cuanto al uso combinado, dependerá de las propiedades del producto y de las terapias concomitantes.
Dependiendo del tipo de cáncer, se recomienda a los pacientes recibir tratamiento con Pembrolizumab hasta que haya evidencia de progresión de la enfermedad o toxicidad inaceptable.

Pacientes con cáncer recibiendo tratamiento en el Hospital Cho Ray (Foto: Hoang Le).
En el tratamiento adyuvante de ciertos cánceres (como el melanoma, el carcinoma de pulmón de células no pequeñas o el carcinoma de células renales), el fabricante recomienda pembrolizumab hasta la recurrencia de la enfermedad, la aparición de toxicidad inaceptable o durante un máximo de 1 año…
Además de las indicaciones del tratamiento, los pacientes también deben prestar atención a las reacciones adversas relacionadas con el sistema inmunitario cuando utilizan Pembroria para realizar los ajustes necesarios, interrumpir temporalmente su uso o suspenderlo indefinidamente.
En concreto, los pacientes pueden experimentar afecciones como neumonía (grado 2-3), colitis (grado 2-3), nefritis, enfermedades endocrinas, hepatitis, reacciones subcutáneas graves...
Si el paciente desarrolla miocarditis, encefalitis, síndrome de Guillain-Barré (polineuropatía aguda) o reacciones posteriores a la inyección graves (grado 3-4), el tratamiento con este medicamento debe suspenderse permanentemente.
Además, no se ha establecido la seguridad ni la eficacia de pembrolizumab en personas menores de 18 años (excepto en pacientes pediátricos con melanoma y linfoma de Hodgkin clásico). Se recomienda administrar el fármaco por vía intravenosa durante 30 minutos, no mediante inyección intravenosa rápida ni en bolo.
Concesión de autorización para realizar investigación clínica
En la Sección 5, Artículo 2 (sobre las responsabilidades de la planta de fabricación y la planta de registro de medicamentos) de la Decisión No. 628/QD-QLD emitida el 31 de octubre, la Administración de Medicamentos de Vietnam, Ministerio de Salud, declaró que, con el medicamento No. 1 en el Apéndice de esta Decisión (Pembroria), después de obtener un certificado de registro de circulación, la empresa debe actualizar periódicamente el progreso de la implementación de la investigación clínica, monitorear la inmunogenicidad de fase III y presentar documentos para cambiar, complementar y actualizar los datos de monitoreo de inmunogenicidad de fase III cuando finaliza el período de investigación.
Según información de la Administración de Medicamentos, Pembroria es un anticuerpo monoclonal, producido a partir del producto biológico de referencia original de la farmacéutica MSD (EE. UU.). Desde 2017, Keytruda, otro medicamento con el principio activo pembrolizumab, está autorizado para su comercialización en Vietnam.
Fuente: https://dantri.com.vn/suc-khoe/thuoc-pembroria-cua-nga-duoc-chi-dinh-cho-cac-loai-ung-thu-gi-20251111231728560.htm



![[Foto] El primer ministro Pham Minh Chinh asiste a una conferencia para revisar un año de despliegue de fuerzas para participar en la protección de la seguridad y el orden a nivel local.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762957553775_dsc-2379-jpg.webp)
![[Foto] Autopistas que atraviesan Dong Nai](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)






























































































![Transición de Dong Nai OCOP: [Artículo 3] Vinculación del turismo con el consumo de productos OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Kommentar (0)