پاکستان در حال بررسی دو توزیعکننده داروی ضد سرطان آواستین، ساخت شرکت سوئیسی روش، پس از آنکه ۱۲ بیمار دیابتی پس از تزریق این دارو نابینا شدند، است. آواستین در ویتنام نیز مجوز دارد.
در ویتنام، تا تاریخ ۲۷ سپتامبر، اداره داروی ویتنام ( وزارت بهداشت ) هیچ گزارشی مبنی بر عوارض جانبی ناخواسته آواستین مربوط به از دست دادن بینایی بیماران پس از استفاده از آواستین دریافت نکرده است.
اداره داروی ویتنام گزارشی از دفتر نمایندگی شرکت اف. هافمن لاروش لیمیتد در مورد این حادثه دریافت کرده است.
به طور خاص، در پاکستان، حدود ۱۲ بیمار پس از استفاده از تزریقاتی که توسط تأمینکننده غیرقانونی Genius Pharmaceutical Service تهیه شده بود، بینایی خود را از دست دادند. این دارو با برچسب "Inj. Avastin 1.25mg/0.05ml" عرضه میشد و باعث این تصور غلط شد که محصول Roche است.
آواستین شرکت روش برای هیچ گونه مصرف چشمی تایید نشده است. شرکت داروسازی جنیوس دوز ۱.۲۵ میلیگرم/۰.۵ میلیلیتر را تحت شرایط غیربهداشتی و تایید نشده عرضه/رقیق/بستهبندی مجدد کرده است.
مقامات پاکستانی در حال بررسی علت آلودگی هستند. علل احتمالی شامل استریلیزاسیون ناکافی، ویالهای آلوده، سرنگهای استریل نشده و انحراف از رویههای عملیاتی استاندارد در هنگام توزیع دارو است.
همزمان، دولت پاکستان درخواست جمعآوری ۳ سری داروی آواستین ۱۰۰ میلیگرم/میلیلیتر (H352B11، B7266B07، B7266B20) شرکت روشه و تمام داروهای عرضه شده توسط شرکت خدمات دارویی جنیوس را داده است.
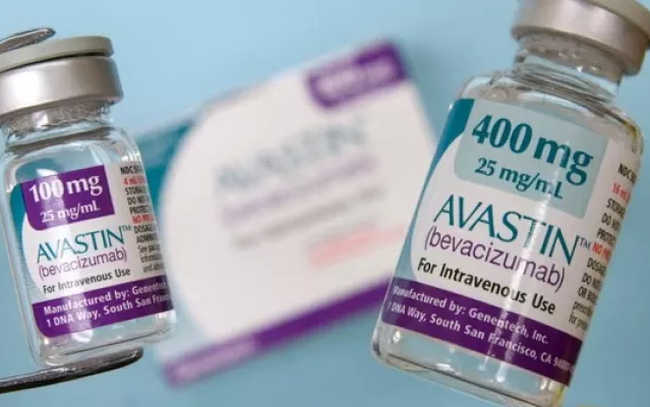
(تصویر: ۲۴ نیوز اچدی).
در ویتنام، به داروی آواستین (ماده مؤثر بواسیزوماب) 4 گواهی ثبت گردش خون اعطا شده است که همگی هنوز معتبر هستند. از جمله:
بواسیزوماب ۱۰۰ میلیگرم/۴ میلیلیتر (جعبه حاوی ۱ ویال × ۴ میلیلیتر؛ شماره ثبت: ۴۰۰۴۱۰۲۵۰۱۲۳ (QLSP-1118- 18)؛ سازنده: Roche Diagnostics GmbH، آلمان).
بواسیزوماب ۴۰۰ میلیگرم/۱۶ میلیلیتر (جعبه ۱ ویال × ۱۶ میلیلیتر: شماره ثبت: ۴۰۰۴۱۰۲۵۰۲۲۳ (QLSP-1119- 18)؛ سازنده: Roche Diagnostics GmbH، آلمان).
بواسیزوماب ۱۰۰ میلیگرم/۴ میلیلیتر (جعبه حاوی ۱ ویال × ۱۶ میلیلیتر؛ شماره ثبت: QLSP-1010-17؛ سازنده: F. Hoffmann-La Roche Ltd.، سوئیس).
بواسیزوماب ۴۰۰ میلیگرم/۱۶ میلیلیتر (جعبه حاوی ۱ ویال × ۱۶ میلیلیتر؛ شماره ثبت: QLSP-1011-17؛ سازنده: F. Hoffmann-La Roche Ltd.، سوئیس).
آواستین در ویتنام برای درمان برخی سرطانها، از جمله سرطان متاستاتیک کولورکتال، سرطان ریه سلول غیرکوچک پیشرفته، متاستاتیک یا عودکننده، کارسینوم سلول کلیوی پیشرفته و/یا متاستاتیک، گلیوبلاستوما/گلیوم بدخیم (مرحله چهارم سازمان بهداشت جهانی)؛ سرطان اپیتلیال تخمدان، لوله فالوپ و سرطان اولیه صفاقی، مجوز دارد.
علاوه بر هشدارهای عمومی، بروشور تایید شده توسط FDA شامل هشداری در مورد «برای استفاده داخل زجاجیهای مناسب نیست» است.
به طور خاص، این دارو ممکن است باعث اختلالات بینایی شود و موارد منفرد و خوشههایی از عوارض جانبی جدی چشمی پس از تزریق داخل زجاجیهای گزارش شده است، روشی تأیید نشده برای تجویز مخلوطهای آواستین از ویالهای در نظر گرفته شده برای تزریق داخل وریدی در بیماران سرطانی.
این واکنشها شامل عفونت داخل چشمی، اندوفتالمیت، یووئیت، جداشدگی شبکیه، پارگی اپیتلیال رنگدانه شبکیه، گلوکوم، خونریزی داخل چشمی و... میشود. برخی از این رویدادها منجر به درجات مختلفی از کاهش میدان دید، از جمله نابینایی دائمی، شدهاند .
منبع


![[عکس] نخست وزیر فام مین چین، ریاست دومین جلسه کمیته راهبری توسعه اقتصاد خصوصی را بر عهده دارد.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/01/1762006716873_dsc-9145-jpg.webp)












































































































نظر (0)