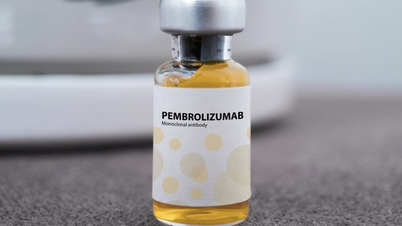
L'Administration des médicaments du Vietnam ( Ministère de la Santé ) a accordé un certificat d'autorisation de mise sur le marché au Vietnam pour le médicament Pembronia, produit en Russie, indiqué dans plus de 14 indications pour différents types de cancer.
Pembroria (principal ingrédient actif : pembrolizumab, concentration : 100 mg/4 ml) est produit par la société à responsabilité limitée « PK-137 » (Russie). Établissement d’enregistrement : Anabion Pharmaceutical Trading Ltd, Émirats arabes unis. Pembroria se présente sous forme de solution concentrée pour perfusion, avec une durée de conservation de 24 mois à compter de la date de fabrication. Conditionnement : flacon de 4 ml.
Le principe actif pembrolizumab a plus de 14 indications pour différents types de cancer (tels que le carcinome pulmonaire, le mélanome, le cancer colorectal, le cancer du col de l'utérus, le carcinome à cellules rénales, le cancer du sein...).
La décision 628/QD-QLD stipule clairement que les établissements de fabrication et d’enregistrement de médicaments sont responsables de : Produire et fournir des médicaments au Vietnam conformément aux registres et documents enregistrés auprès du ministère de la Santé .
L'établissement d'enregistrement des médicaments doit rendre compte au ministère de la Santé du maintien de la conformité aux bonnes pratiques de fabrication (BPF) de l'établissement de fabrication des médicaments et des ingrédients pharmaceutiques. Si l'autorisation de fabrication de cet établissement est révoquée ou s'il ne respecte pas les BPF des médicaments et des ingrédients pharmaceutiques dans son pays d'origine, l'établissement doit en informer ce dernier dans les 15 jours suivant la notification par l'autorité de gestion compétente de ce pays.
Dans le même temps, il convient de se coordonner avec les établissements de soins et les structures de médecine préventive afin de se conformer à la réglementation en vigueur sur les médicaments sur ordonnance, de surveiller l'innocuité, l'efficacité et les effets indésirables des médicaments sur la population vietnamienne, et de synthétiser et de rendre compte conformément à la réglementation.
L'Administration des médicaments du Vietnam exige qu'après l'obtention d'un certificat d'autorisation de mise sur le marché, l'entreprise mette à jour périodiquement tous les 3 mois, à compter de la date de délivrance du certificat, l'état d'avancement des recherches cliniques sur le suivi de l'immunogénicité de phase III et soumette les documents nécessaires à la modification et à la mise à jour des données de suivi de l'immunogénicité de phase III à la fin de la période de recherche.
Source : https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html






![[Photo] Le Premier ministre Pham Minh Chinh reçoit le ministre laotien du Travail et des Affaires sociales, Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)






![[Vidéo] De nombreux équipements se dégradent car la mise en service de deux grands hôpitaux est lente.](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762906839099_dung00-29-15-18still010-jpg.webp)




![[Vidéo] Chu Nhat Quang - De « marque sacrée » à record du monde](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762909239247_2385424671828914264-8140-jpg.webp)

![[Vidéo] Les projets de documents du 14e Congrès national soulignent le rôle clé des affaires étrangères](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762905940110_dung00-24-48-14still009-jpg.webp)




























































![[Infographie animée] Comment soumettre un livre rouge sur VNeID](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762909837040_fb_thum-web-bht-1.jpeg)








![Transition de Dong Nai à l'OCOP : [Article 3] Lier le tourisme à la consommation de produits de l'OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Comment (0)