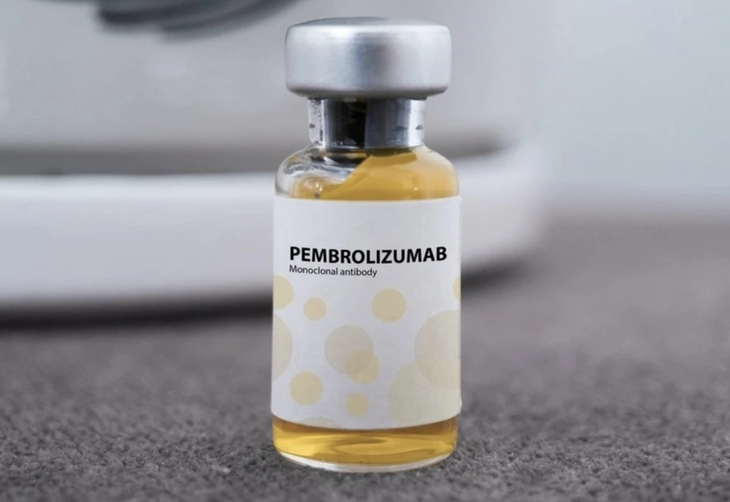
러시아에서 생산된 펨브로리아 의약품 - 사진: 인센트라
베트남 보건부 약품감독관리국(DHA)은 14개 백신 및 생물학적 제제에 대한 베트남 유통 허가를 발급했습니다. 그중에는 펨브로리아(Pembroria)가 있는데, 이 약물의 주성분은 펨브롤리주맙(Pembrolizumab)이며, 함량은 100mg/4ml입니다. 이 약물은 러시아 유한책임회사 "PK-137"(아랍에미리트)에서 생산하며, 베트남 유통을 위해 등록된 아랍에미리트 시설에서 생산됩니다.
어제인 11월 11일부터 많은 사람들이 이 정보에 관심을 보였습니다. 펨브로리아가 임상 3상 단계에 진입하여 베트남에 막 진출했다는 정보가 있었기 때문입니다. 아직 공식 제품은 아니며, 유통이 매우 빠르다는 것입니다. 또 다른 정보에서는 이 제품이 완전히 새로운 제품이며 "많은 환자들에게 희망을 준다"고 주장하며, 심지어 "암 백신"이라고 부르기도 합니다.
오늘 11월 12일 아침 기자들에게 말한 약물 관리 부서의 한 대표는 위의 두 가지 정보 흐름이 모두 부정확하다고 말했습니다.
이 사람에 따르면, 베트남에서 유통을 위한 등록 번호를 부여받기 전에 하노이 의대의 약리학 전문가가 제품 프로필을 평가하여 원래 약물과 유사한 효과와 면역원성에 대한 요구 사항을 완전히 충족하는 것으로 확인되었습니다.
이 제품은 단일클론 항체 형태이며, 1, 2, 3상 임상시험을 거쳤고, 가장 최근 3상은 2024년 1월에 종료되었습니다. 그러나 베트남에 등록할 때, 위원회는 면역원성, 효과, 위험 관리 등에 대해 3개월마다 정기적으로 평가를 계속하도록 더욱 엄격한 요건을 요구했습니다.
"이 요건은 일반적인 수준보다 높습니다. 일부 사람들이 오해하는 것처럼, 이 제품은 임상시험을 완료하지 않은 제품이 아니라 유통을 위해 등록된 제품입니다. 또 다른 문제는 이 제품이 백신이 아니라 치료제라는 점입니다."라고 식약처 관계자는 말했습니다.
그러나 이 단일클론 항체는 베트남에서 처음 개발된 새로운 발명품이 아니며, 베트남에서는 2017년부터 이미 수년 전부터 동일한 유형의 단일클론 항체(제네릭 의약품)를 유통해 왔습니다. 미국 식품의약국(FDA)은 11월 11일 기준 펨브로리아를 포함한 99종의 암 치료용 약물 및 단일클론 항체의 유통을 허가했습니다.
유사 제품과 마찬가지로, Pembroria는 흑색종, 비소세포 폐암, 고전적 호지킨 림프종, 요로 상피암, 식도암, 대장암, 자궁경부암, 삼중 음성 유방암, 위선암, 담관암 등의 치료에 사용됩니다.
치료는 경험이 풍부한 전문가의 처방 및 감독 하에 이루어져야 합니다. 상황에 따라 펨브로리아는 성인이나 12세 이상의 청소년 치료에 사용될 수 있습니다.
Pembroria 단일클론 항체에 대해 알아야 할 사항
이 약은 러시아 바이오캐드(Biocad)에서 제조되었으며, UAE에 본사를 둔 한 회사가 베트남에서 유통을 위해 등록했습니다. 이 등록을 통해 이 약은 특수 또는 제한 약물 그룹에 속하지 않기 때문에 다른 약물과 마찬가지로 수입, 유통 및 널리 사용될 수 있습니다.
이전에는 2017년에 MSD 그룹(미국)의 키트루다(Keytruda)라는 약물이 베트남에서 허가되었습니다. 이 약물은 활성 성분인 펨브롤리주맙을 함유한 제네릭 약물입니다.
키트루다와 펨브로리아는 모두 신체의 면역 체계가 암세포를 인식하고 공격하는 데 도움이 되는 단일클론 항체인 활성 성분인 펨브롤리주맙을 함유하고 있습니다.
베트남 암 환자들이 암 치료 수요 증가에 따라 면역 요법을 사용할 때 더 많은 허가 의약품을 확보할 수 있게 되었습니다. 특히 제품 가격 측면에서 한 전문가는 이 제품의 가격이 오리지널 의약품보다 확실히 낮을 것이라고 말했지만, 오리지널 의약품 제조사 측에서도 가격 인하를 위한 로드맵을 가지고 있습니다.
러시아에서는 펨브로리아가 2022년 4월부터 승인되었습니다.
출처: https://tuoitre.vn/nga-cancer-treatment-drug-is-approved-or-is-it-just-a-sang-treatment-test-or-is-it-just-a-sang-test-in-viet-nam-20251112120926097.htm





































































































![동나이 OCOP 전환: [제3조] 관광과 OCOP 제품 소비 연계](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








댓글 (0)