유럽에서는 모든 나라의 모든 환자가 동등하게 의료에 접근할 수 있는 것은 아닙니다. 전문가들은 이 상황을 " 우편 복권" 프로그램에 비유합니다.
루마니아에서는 많은 약품이 독일보다 2년 늦게 배포됩니다. 서유럽과 동유럽의 환자가 같은 중증 질환 진단을 받더라도 생사 여부는 매우 다른 결과를 맞이하게 됩니다. 폴리티코는 이 상황을 우편 복권에 비유했습니다.
"서유럽과 주요 국가의 환자들은 새로 승인된 의약품의 90%를 이용할 수 있습니다. 동유럽과 소규모 국가의 환자들은 그 수치가 10%에 불과합니다. 이는 절대 용납할 수 없는 일입니다."라고 EU 보건 집행 위원 스텔라 키리아키데스는 4월 연설에서 말했습니다.
EU 고위 관리들이 유럽 대륙의 의약품 시장 개혁안을 제시하고 있습니다. 이는 접근성 불평등 문제를 해결하기 위한 것입니다. 2년 이내에 EU 27개 시장 모두에 제품을 출시하지 못하는 기업들은 처벌받아야 한다고 주장합니다. 모든 환자가 안전하고 효과적이며 저렴하고 공정하며 공평한 의약품에 적시에 접근할 수 있도록 보장하는 단일 시장을 구축하는 것이 목표입니다.
하지만 여기에는 많은 장애물이 있습니다. 첫째, 재정 문제입니다 . 실제로 일부 의약품은 매우 비쌉니다. 한편, EU 27개국 간에는 경제적 격차가 매우 큽니다. 예를 들어 불가리아의 1인당 소득은 네덜란드보다 거의 5배 낮습니다. 이는 일부 국가가 다른 국가보다 의료 시스템, 특히 의약품에 더 많은 비용을 지출한다는 것을 의미합니다.
스웨덴 보건경제연구소(IHE)의 유럽 항암제 시장 분석에 따르면, 가장 많은 비용을 지출하는 국가는 오스트리아, 독일, 스위스입니다. 이 세 국가의 1인당 항암제 지출액은 92~108유로인 반면, 체코, 라트비아, 폴란드는 13~16유로입니다.
지출이 줄면 처방도 줄어듭니다. 예를 들어, 무료 항암제의 경우, 저소득 국가에서는 사용량이 부유한 국가의 10분의 1에서 5분의 1 수준입니다.
연구진은 "가격 부담 문제로 인해 유럽 암 환자, 특히 동유럽 환자의 상당수가 효과적인 약물을 구할 수 없다"고 지적했습니다.
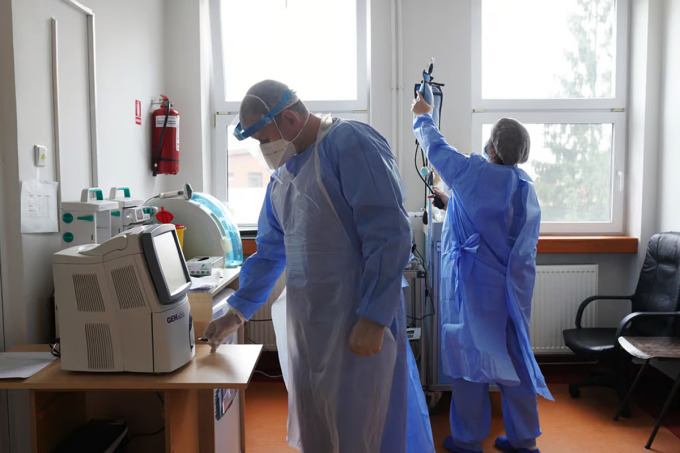
병원에서 일하는 의사들. 사진: 안드레아 캄페아누
더 복잡한 이유는 약물 가격 책정 방식이 불투명하고 매우 특이하기 때문입니다. 제약 회사들은 가격을 협상하기 위해 정부와 직접 비밀리에 협상하기 때문에, 어느 나라도 다른 나라가 같은 약물에 얼마를 지불하는지 정확히 알 수 없습니다. 이것이 단연 가장 흔한 형태입니다.
"제약 회사들은 먼저 더 높은 가격을 지불할 가능성이 높은 국가에서 신약을 출시하기로 합니다. 포르투갈, 그리스, 동유럽과 같은 남유럽 국가에서는 2~3년 후쯤에 신약이 제안됩니다."라고 오스트리아 국립 공공재단의 제약 경제학 책임자인 자비네 포글러는 설명합니다.
고소득 국가의 정부는 공개적으로 발표되는 "기준 가격"을 설정합니다. 그러나 이 가격은 사전에 비밀 협상을 통해 협상되며, 할인율은 공개되지 않습니다. 이러한 과정은 이후 국가들에 대해서도 반복되며, 공개된 기준 가격을 협상의 기준으로 삼습니다. 결과적으로 "덜 매력적이라고 여겨지는" 시장의 국가들은 결국 최하위에 머물게 됩니다.
제약 산업의 경우, 이러한 과정의 근본 원인은 정부가 새로운 약물에 대한 비용을 지불하도록 강요하는 서류 작업 입니다.
제약 로비 단체 EFPIA의 분석에 따르면, "의약품 협상 신청은 시간이 많이 소요됩니다. 각 국가는 현지 언어로 작성된 맞춤형 문서를 요구하며 현지 규정을 준수해야 합니다."
이론적으로 EU 투명성 지침은 각국이 180일 이내에 의약품에 대한 지불 금액을 결정하도록 요구합니다. 그러나 실제로는 일부 지역에서는 규제 기관과 정부가 기업에 추가 데이터 제공을 요청할 경우 해당 기간이 연장될 수 있습니다.
5개국에서 개인 맞춤형 항암제에 접근하는 데 걸리는 평균 시간을 조사한 결과, 덴마크는 약물 비용 지불 여부를 결정하는 데 4개월 이상이 소요되는 것으로 나타났습니다. 폴란드는 최대 30일이 소요되었습니다.
EU는 공동 보건 기술 평가(Common Health Technology Assessment)를 도입할 계획입니다. 이는 신약에 대한 단일의 블록 단위 평가를 제공하고 각국의 지불 금액 결정에 도움을 줄 것입니다. 기업들은 현재처럼 각 의약품에 대해 27건의 신청서를 제출해야 하는 대신, 한 건만 제출하면 됩니다. 첫 번째 공동 평가는 2025년에 실시될 예정입니다.
벨기에, 네덜란드, 룩셈부르크, 오스트리아, 아일랜드를 포함한 베네룩스 의약품 정책 이니셔티브(Beneluxa Initiative for Pharmaceutical Policy) 회원국들은 이미 의약품 구매를 위한 협력을 시작했으며, 이를 통해 제조업체의 협상이 간소화되고 구매자의 협상력이 강화되었습니다. 그러나 유럽 집행위원회가 제안한 개혁안이 가장 야심 찬 것입니다.
Thuc Linh ( 폴리티코 에 따르면)
[광고_2]
소스 링크


































































































댓글 (0)