Pada 11 November, Pentadbiran Dadah Vietnam, Kementerian Kesihatan mengumumkan bahawa ia baru sahaja mengeluarkan Keputusan No. 628/QD-QLD bertarikh 31 Oktober mengenai 14 vaksin dan produk biologi yang diberikan pendaftaran untuk edaran di Vietnam.
Antaranya, terdapat ubat Pembroria (bahan aktif utama ialah Pembrolizumab, kandungan 100mg/4ml) yang dikeluarkan oleh Syarikat Liabiliti Terhad "PK-137" (Rusia), yang didaftarkan oleh kemudahan di Emiriah Arab Bersatu.
Ubat Pembroria disediakan dalam bentuk penyelesaian pekat untuk infusi, dengan jangka hayat 24 bulan dari tarikh pembuatan.
Pembrolizumab pada masa ini mempunyai lebih daripada 14 tanda untuk jenis kanser yang berbeza (seperti karsinoma paru-paru, melanoma, kanser kolorektal, kanser serviks, karsinoma sel renal, kanser payudara...)
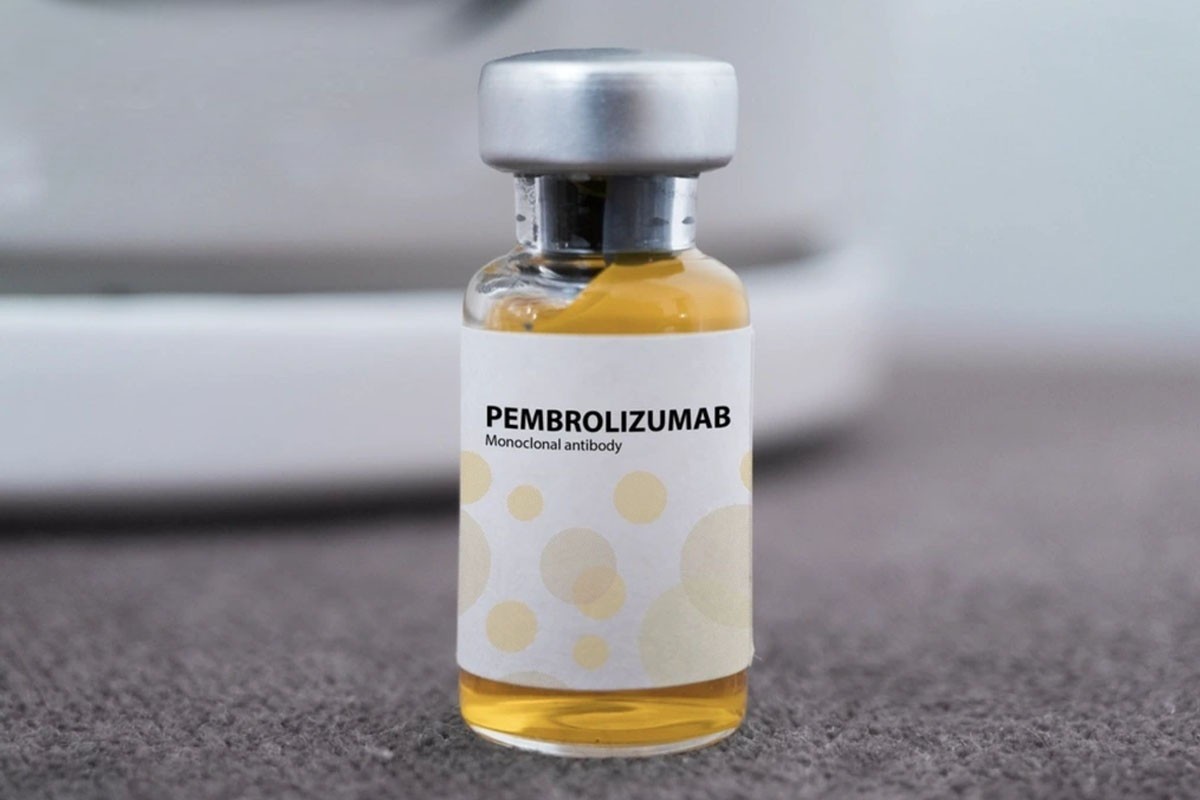
Ubat Pembroria mempunyai bahan aktif utama Pembrolizumab.
Menurut Pentadbiran Dadah, selepas diberikan sijil pendaftaran edaran, syarikat mesti mengemas kini secara berkala kemajuan penyelidikan klinikal mengenai pemantauan imunogenisiti fasa III setiap 3 bulan dari tarikh pengeluaran sijil pendaftaran edaran. Serahkan dokumen untuk menukar dan mengemas kini data pemantauan imunogenisitas fasa III apabila tempoh penyelidikan tamat.
Selain Pembroria, vaksin dan produk biologi yang telah diberikan sijil pendaftaran edaran termasuk:
- Metalyse: Bahan aktif utama: Tenecteplase; Nombor pendaftaran: 400410440125
- Spevigo: Bahan aktif: Spesolimab; Nombor pendaftaran: 400410440225
- Remsima: Bahan aktif: Infliximab; Nombor pendaftaran: 400410440325
- Soliris: Bahan aktif: Eculizumab; Nombor pendaftaran: 539410440425
- Flumist: Bahan aktif: Vaksin influenza hidup (dilemahkan); Nombor pendaftaran: 001310440525
- Saphnelo: Bahan aktif utama: Anifrolumab; Nombor pendaftaran: 870410440625
- Darzalex SC: Bahan aktif: Daratumumab; Nombor pendaftaran: 760410440725
- Ruxience: Bahan aktif: Rituximab; Nombor pendaftaran: 540410440825
- Forsteo: Bahan aktif utama: Teriparatide; Nombor pendaftaran: 300410440925
- Ocrevus: Bahan aktif: Ocrelizumab; Nombor pendaftaran: 400410441025
- Bemfola: Bahan aktif utama: RHFSH (follitropin alfa); Nombor pendaftaran: 500410441125
- Ziextenzo: Bahan aktif utama: Pegfilgrastim; Nombor pendaftaran: 900410441225
- Repatha: Bahan aktif: Evolocumab; Nombor pendaftaran: 001410441325
Pentadbiran Dadah menghendaki semua unit bertanggungjawab ke atas semua ubat yang dikeluarkan dan dibekalkan ke Vietnam untuk mematuhi rekod dan dokumen yang didaftarkan dengan Kementerian Kesihatan . Setiap produk mesti mempunyai nombor pendaftaran yang dikeluarkan oleh Kementerian Kesihatan yang dicetak atau dilekatkan pada label ubat untuk memastikan ketelusan dan kebolehkesanan.
Kemudahan ini mesti mematuhi sepenuhnya undang-undang dan peraturan Kementerian Kesihatan Vietnam mengenai pengeluaran, import dan pengedaran dadah. Sekiranya terdapat sebarang perubahan yang berkaitan dengan ubat semasa peredaran di negara asal atau di Vietnam, kemudahan tersebut hendaklah segera melaporkan kepada Pentadbiran Dadah Kementerian Kesihatan.
Bagi pertubuhan pendaftaran ubat, mengekalkan amalan pengilangan yang baik (GMP) pertubuhan pengilangan ubat dan bahan mentah adalah wajib. Sekiranya kemudahan pengilangan dibatalkan atau tidak lagi memenuhi piawaian GMP di negara asal, pertubuhan pendaftaran ubat mesti melaporkan kepada Kementerian Kesihatan dalam tempoh 15 hari dari tarikh penerimaan pemberitahuan rasmi, seperti yang ditetapkan dalam Perkara 98 Dekri 163/2025/ND-CP.
Di samping itu, kemudahan pembuatan dan pendaftaran ubat perlu menyelaras dengan kemudahan rawatan dan kemudahan perubatan pencegahan untuk melaksanakan sepenuhnya peraturan mengenai ubat preskripsi, memantau keselamatan, keberkesanan dan kesan yang tidak diingini ke atas rakyat Vietnam.
Sumber: https://baolaocai.vn/thuoc-chong-ung-thu-cua-nga-duoc-dang-ky-cap-phep-tai-viet-nam-post886566.html




![[Foto] Perdana Menteri Pham Minh Chinh menerima Menteri Buruh dan Kebajikan Laos Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)


























































































![[Grafik Bergerak] Cara menyerahkan buku merah pada VNeID](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762909837040_fb_thum-web-bht-1.jpeg)








![Peralihan OCOP Dong Nai: [Perkara 3] Menghubungkan pelancongan dengan penggunaan produk OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Komen (0)