Op 11 november heeft de Vietnamese geneesmiddelenadministratie volgens informatie van het Ministerie van Volksgezondheid een registratiecertificaat afgegeven voor het geneesmiddel tegen kanker, Pembroria, dat door Rusland wordt geproduceerd, samen met 13 andere vaccins en biologische producten.
Overeenkomstig Besluit nr. 628/QD-QLD van de Drug Administration of Vietnam werd aan 14 vaccins en biologische producten een registratiecertificaat voor distributie in Vietnam verleend met een geldigheidsduur van 3 jaar (batch 57).
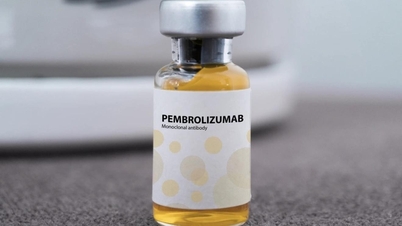
In de bij bovenstaand besluit gevoegde lijst is het geneesmiddel Pembroria (het belangrijkste werkzame bestanddeel is Pembrolizumab, gehalte 100 mg/4 ml) opgenomen, geproduceerd door de besloten vennootschap met beperkte aansprakelijkheid "PK-137" (Rusland), geregistreerd bij een vestiging in de Verenigde Arabische Emiraten.
Pembroria-medicijn wordt bereid in de vorm van een geconcentreerde oplossing voor infusie, met een houdbaarheid van 24 maanden vanaf de productiedatum.
Volgens informatie van het agentschap voor geneesmiddelenregistratie heeft Pembrolizumab meer dan 14 indicaties voor verschillende soorten kanker (zoals longkanker, melanoom, colorectale kanker, baarmoederhalskanker, niercelkanker, borstkanker...).
Naast het medicijn Pembroria bevinden zich in deze registratieronde ook vaccins en medische biologische producten voor de behandeling van beroertes, lupus, osteoporose, huidziekten, reumatoïde artritis, de ziekte van Bechterew, bloedziekten, multiple sclerose...
Besluit 628/QD-QLD stelt duidelijk dat instellingen die geneesmiddelen produceren en registreren verantwoordelijk zijn voor: Het produceren en leveren van geneesmiddelen aan Vietnam in overeenstemming met de gegevens en documenten die geregistreerd staan bij het Ministerie van Volksgezondheid.
Geneesmiddelenregistratie-instellingen moeten aan het Ministerie van Volksgezondheid rapporteren over de naleving van de Goede Productiepraktijken van de productiebedrijven voor geneesmiddelen en farmaceutische ingrediënten. Indien de productievergunning van een productiebedrijf wordt ingetrokken of de Goede Productiepraktijken voor geneesmiddelen en farmaceutische ingrediënten in het thuisland niet worden nageleefd, moet het bedrijf binnen 15 dagen na de datum van kennisgeving door de bevoegde beheersinstantie van het thuisland een rapport indienen.
De Drug Administration van Vietnam vereist dat het moederbedrijf, nadat een registratiecertificaat voor de circulatie van een geneesmiddel is verleend, periodiek een update moet geven over de voortgang van klinisch onderzoek naar immunogeniciteitsmonitoring in fase III. Deze update vindt elke 3 maanden plaats vanaf de datum van afgifte van het registratiecertificaat voor de circulatie. Ook moet het moederbedrijf documenten indienen om de bijgewerkte gegevens over immunogeniciteitsmonitoring in fase III te wijzigen en aan te vullen wanneer de onderzoeksperiode afloopt.
Bron: https://www.vietnamplus.vn/bo-y-te-cap-giay-dang-ky-luu-hanh-cho-thuoc-chong-ung-thu-cua-nga-post1076341.vnp





![[Foto] Snelwegen die door Dong Nai lopen](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)



























































































![Dong Nai OCOP-transitie: [Artikel 3] Toerisme koppelen aan OCOP-productconsumptie](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Reactie (0)