Op 11 november maakte de Vietnamese geneesmiddelenadministratie, ministerie van Volksgezondheid , bekend dat zij zojuist Besluit nr. 628/QD-QLD van 31 oktober had uitgevaardigd over 14 vaccins en biologische producten die geregistreerd zijn voor distributie in Vietnam.
Daaronder bevindt zich het medicijn Pembroria (het belangrijkste werkzame bestanddeel is Pembrolizumab, inhoud 100mg/4ml), geproduceerd door de besloten vennootschap met beperkte aansprakelijkheid "PK-137" (Rusland), geregistreerd bij een vestiging in de Verenigde Arabische Emiraten.
Pembroria-medicijn wordt bereid in de vorm van een geconcentreerde oplossing voor infusie, met een houdbaarheid van 24 maanden vanaf de productiedatum.
Pembrolizumab heeft momenteel meer dan 14 indicaties voor verschillende soorten kanker (zoals longkanker, melanoom, colorectale kanker, baarmoederhalskanker, niercelkanker, borstkanker...)
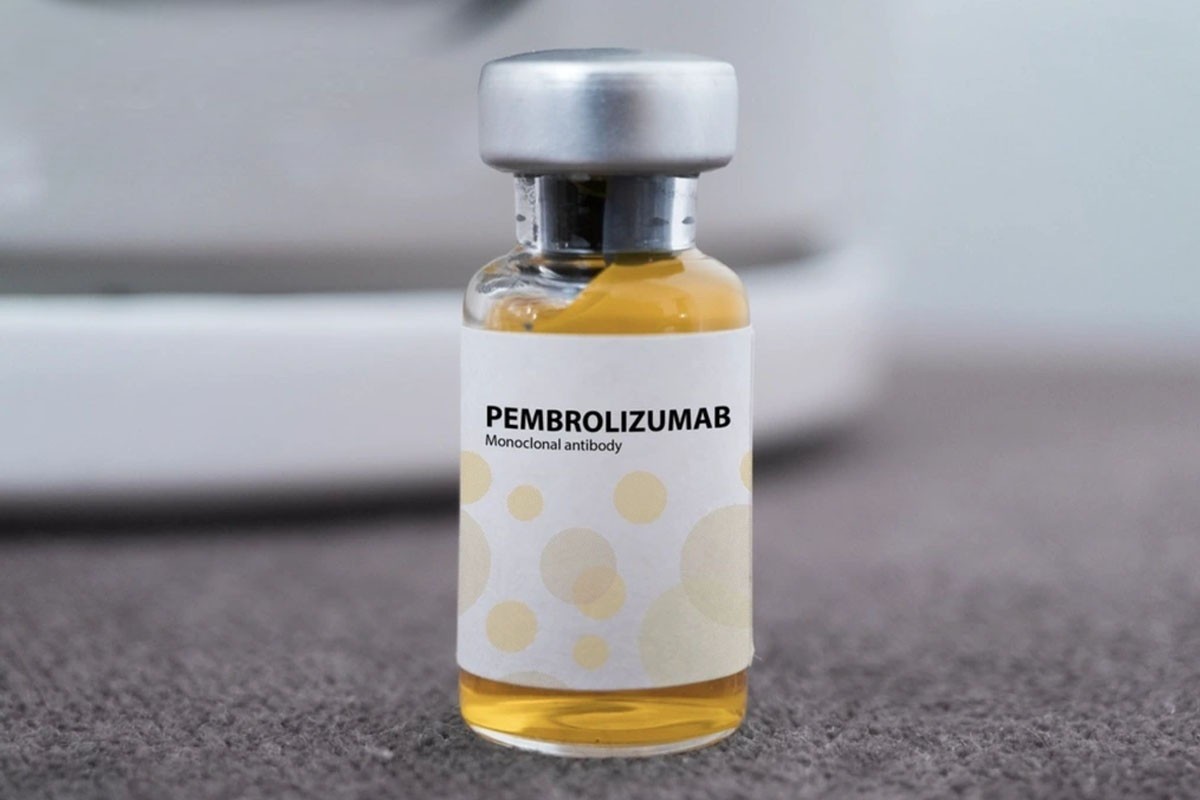
Het belangrijkste werkzame bestanddeel van het medicijn Pembroria is Pembrolizumab.
Volgens de Drug Administration moet het bedrijf, na het verkrijgen van een registratiecertificaat voor de circulatie, de voortgang van het klinisch onderzoek naar de monitoring van de immunogeniciteit in fase III periodiek bijwerken, elke drie maanden vanaf de datum van afgifte van het registratiecertificaat voor de circulatie. Na afloop van de onderzoeksperiode moeten documenten worden ingediend om gegevens over de monitoring van de immunogeniciteit in fase III te wijzigen en bij te werken.
Naast Pembroria omvatten de vaccins en biologische producten waarvoor een circulatieregistratiecertificaat is verleend:
- Metalyse: Belangrijkste werkzame bestanddeel: Tenecteplase; Registratienummer: 400410440125
- Spevigo: Actief bestanddeel: Spesolimab; Registratienummer: 400410440225
- Remsima: Actief bestanddeel: Infliximab; Registratienummer: 400410440325
- Soliris: Actief bestanddeel: Eculizumab; Registratienummer: 539410440425
- Flumist: Actief bestanddeel: Levend influenzavaccin (verzwakt); Registratienummer: 001310440525
- Saphnelo: Belangrijkste werkzame bestanddeel: Anifrolumab; Registratienummer: 870410440625
- Darzalex SC: Actief bestanddeel: Daratumumab; Registratienummer: 760410440725
- Ruxience: Actief bestanddeel: Rituximab; Registratienummer: 540410440825
- Forsteo: Belangrijkste werkzame bestanddeel: Teriparatide; Registratienummer: 300410440925
- Ocrevus: Actief bestanddeel: Ocrelizumab; Registratienummer: 400410441025
- Bemfola: Belangrijkste werkzame bestanddeel: RHFSH (follitropine alfa); Registratienummer: 500410441125
- Ziextenzo: Belangrijkste werkzame bestanddeel: Pegfilgrastim; Registratienummer: 900410441225
- Repatha: Actief bestanddeel: Evolocumab; Registratienummer: 001410441325
De Drug Administration vereist dat alle afdelingen verantwoordelijk zijn voor alle medicijnen die aan Vietnam worden geproduceerd en geleverd, en dat deze voldoen aan de registratie- en documentatievoorschriften van het Ministerie van Volksgezondheid . Elk product moet voorzien zijn van het door het Ministerie van Volksgezondheid uitgegeven registratienummer, afgedrukt of op het etiket van het medicijn aangebracht, om transparantie en traceerbaarheid te garanderen.
Deze faciliteiten moeten volledig voldoen aan de Vietnamese wet- en regelgeving van het Ministerie van Volksgezondheid met betrekking tot de productie, import en distributie van geneesmiddelen. Eventuele wijzigingen in de geneesmiddelen tijdens de distributie in het thuisland of in Vietnam moeten onmiddellijk worden gemeld aan de Geneesmiddelenadministratie van het Ministerie van Volksgezondheid.
Voor instellingen die geneesmiddelen registreren, is het handhaven van goede productiepraktijken (GMP) verplicht voor de productie van geneesmiddelen en grondstoffen. Indien de vergunning van de productiefaciliteit wordt ingetrokken of niet langer voldoet aan de GMP-normen in het thuisland, moet de instelling die geneesmiddelen registreert, dit binnen 15 dagen na ontvangst van de officiële kennisgeving melden bij het Ministerie van Volksgezondheid, zoals voorgeschreven in artikel 98 van Decreet 163/2025/ND-CP.
Bovendien moeten productie- en registratiefaciliteiten voor medicijnen samenwerken met behandelcentra en preventieve medische instellingen om de regelgeving omtrent receptgeneesmiddelen volledig te implementeren en de veiligheid, effectiviteit en ongewenste effecten op de Vietnamese bevolking te monitoren.
Bron: https://baolaocai.vn/thuoc-chong-ung-thu-cua-nga-duoc-dang-ky-cap-phep-tai-viet-nam-post886566.html


![[Foto] Premier Pham Minh Chinh woont een conferentie bij om een jaar van inzet van troepen bij te wonen die bijdragen aan het beschermen van de veiligheid en orde op lokaal niveau.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762957553775_dsc-2379-jpg.webp)

![[Foto] Snelwegen die door Dong Nai lopen](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)



































































































![Dong Nai OCOP-transitie: [Artikel 3] Toerisme koppelen aan OCOP-productconsumptie](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Reactie (0)