Volgens professor dr. Le Van Quang, directeur van het K-ziekenhuis, zal de eenheid binnenkort Pembroria-medicijn In het behandelplan voor kankerpatiënten. Het medicijn Pembroria (Rusland) wordt geproduceerd en kost ongeveer 18 miljoen VND per fles. Patiënten gebruiken meestal twee flessen per kuur. De behandeling duurt 12 tot 24 kuren, of totdat de patiënt niet meer op het medicijn reageert. Momenteel wordt het medicijn niet vergoed door de zorgverzekering .
Volgens een vertegenwoordiger van de Drug Administration ( Ministerie van Volksgezondheid ) heeft Pembroria klinische studies afgerond en is het officieel goedgekeurd voor distributie in Vietnam. Het medicijn wordt geproduceerd door Biocad (Rusland), geregistreerd bij een bedrijf met hoofdkantoor in de VAE. De vergunning staat import, distributie en breed gebruik van het medicijn toe en behoort niet tot de groep speciale of beperkte medicijnen.
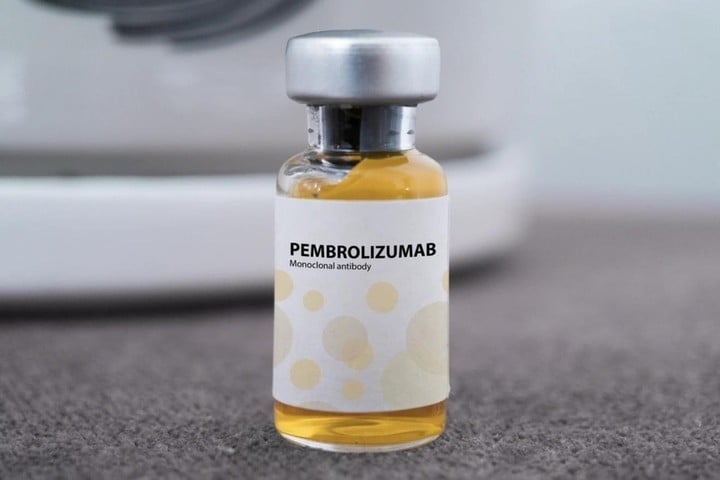
Pembroria is in wezen een "biosimilar" van Keytruda, het oorspronkelijke product ontwikkeld door MSD (VS), dat ook de werkzame stof pembrolizumab bevat. Dit is een monoklonaal antilichaam dat het immuunsysteem helpt kankercellen te herkennen en te vernietigen, en wordt beschouwd als een van de meest effectieve immunotherapieën van dit moment. Keytruda werd in 2014 goedgekeurd door de VS en in 2017 goedgekeurd voor distributie in Vietnam.
De komst van Pembroria zal naar verwachting kankerpatiënten meer toegang tot behandeling bieden, terwijl de kosten aanzienlijk lager liggen – ongeveer VND 18 miljoen per injectieflacon, vergeleken met VND 55-65 miljoen voor Keytruda. Beide geneesmiddelen worden echter nog steeds niet vergoed door de zorgverzekering.
Pembrolizumab werkt door middel van 'snelle afgifte' aan T-immuuncellen. Normaal gesproken, kankercellen Stuurt een "stop"-signaal dat voorkomt dat T-cellen aanvallen. Het medicijn blokkeert dit signaal en activeert zo het vermogen om tumoren te vernietigen. Dit is effectief bij veel soorten kanker, zoals longkanker, nierkanker, baarmoederhalskanker en melanoomkanker.
Volgens de Drug Administration heeft het bedrijf het volledige dossier voor de vergunning voor de distributie van het geneesmiddel ingediend conform de regelgeving. In 2024 waren de klinische studies voor dit geneesmiddel afgerond. Het bedrijf bleef echter een immunogeniciteitsbeoordeling uitvoeren – een verplichte vereiste voor biosimilars zoals dit product, geen nieuwe klinische studie.
Tijdens het circulatieproces zijn ondernemingen verantwoordelijk voor het monitoren en periodiek rapporteren over de veiligheid, effectiviteit en immunogeniciteit van het geneesmiddel na 3 of 5 jaar, zoals vereist door de beheersinstantie.
Eerder waren veel geneesmiddelen met het actieve ingrediënt pembrolizumab goedgekeurd voor distributie in het land. Besluit 628/QD-QLD van de Drug Administration van 31 oktober keurde 14 vaccins en biologische producten goed, waaronder Pembroria (100 mg/4 ml), geconcentreerde oplossing voor infusie, met een vervaldatum van 24 maanden vanaf de productiedatum.
Bron: https://baolangson.vn/thuoc-ung-thu-pembroria-cua-nga-vua-duoc-cap-phep-tai-viet-nam-co-gia-bao-nhieu-5064810.html


![[Foto] Unieke architectuur van het diepste metrostation van Frankrijk](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/14/1763107592365_ga-sau-nhat-nuoc-phap-duy-1-6403-jpg.webp)

![[Foto] Unieke kunst van het schilderen van Tuong-maskers](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/14/1763094089301_ndo_br_1-jpg.webp)

![[Foto] Speciale klasse in Tra Linh](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/14/1763078485441_ndo_br_lop-hoc-7-jpg.webp)





















![[Foto] Diepzeezandafzettingen, oud houten schip An Bang loopt risico opnieuw begraven te worden](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1763033175715_ndo_br_thuyen-1-jpg.webp)


































































![Dong Nai OCOP-transitie: [Artikel 3] Toerisme koppelen aan OCOP-productconsumptie](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)




Reactie (0)