Den 11. november kunngjorde Vietnams legemiddeltilsyn, helsedepartementet, at de nettopp hadde utstedt beslutning nr. 628/QD-QLD datert 31. oktober om 14 vaksiner og biologiske produkter som er registrert for sirkulasjon i Vietnam.
Blant dem er legemidlet Pembroria (hovedvirkende ingrediens er Pembrolizumab, innhold 100 mg/4 ml) produsert av Limited Liability Company «PK-137» (Russland), registrert av et anlegg i De forente arabiske emirater.
Pembroria-medisin tilberedes i form av en konsentrert infusjonsløsning, med en holdbarhet på 24 måneder fra produksjonsdatoen.
Pembrolizumab har for tiden mer enn 14 indikasjoner for ulike typer kreft (som lungekreft, melanom, tykktarmskreft, livmorhalskreft, nyrecellekreft, brystkreft...)
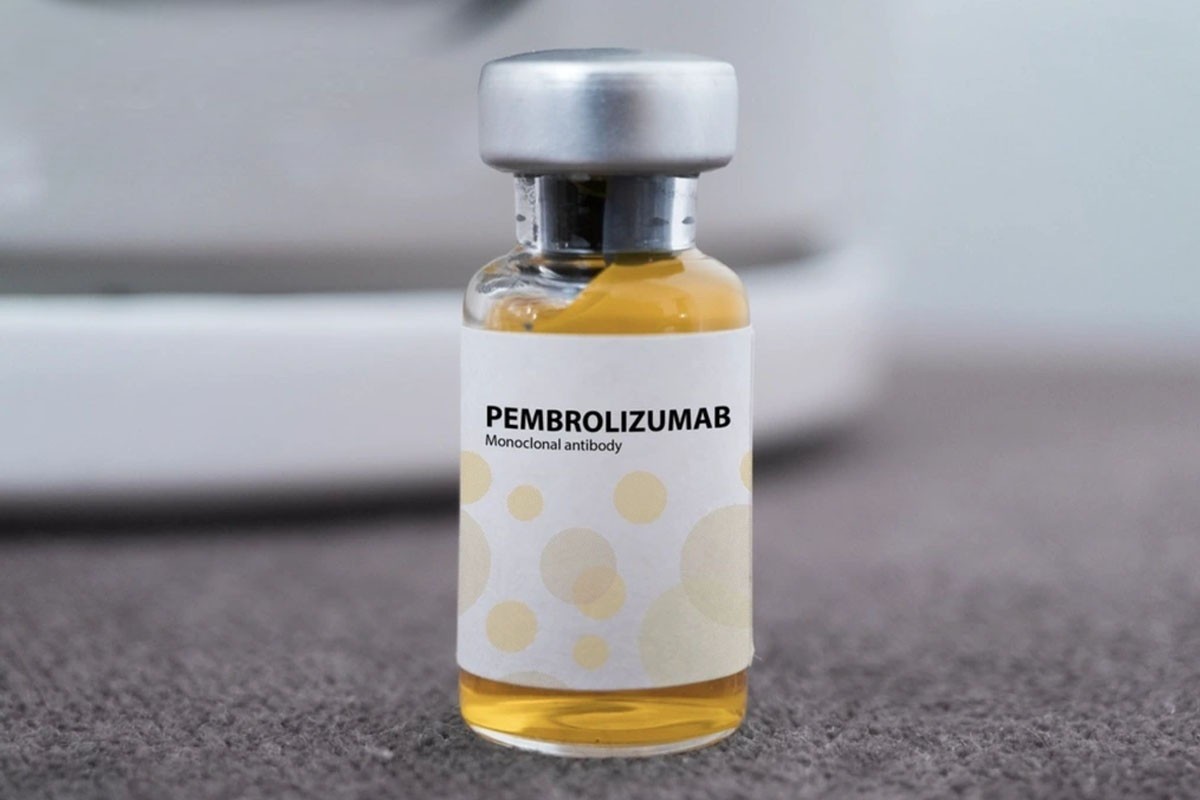
Pembroria-medisin har den viktigste aktive ingrediensen pembrolizumab.
Ifølge Legemiddeltilsynet må selskapet, etter å ha fått innvilget et sirkulasjonsregistreringsbevis, regelmessig oppdatere fremdriften i klinisk forskning på overvåking av fase III-immunogenisitet hver tredje måned fra utstedelsesdatoen for sirkulasjonsregistreringsbeviset. Send inn dokumenter for å endre og oppdatere data om overvåking av fase III-immunogenisitet når forskningsperioden er over.
I tillegg til Pembroria inkluderer vaksiner og biologiske produkter som har fått tildelt sirkulasjonsregistreringsbevis:
- Metalyse: Hovedvirkestoff: Tenecteplase; Registreringsnummer: 400410440125
- Spevigo: Aktiv ingrediens: Spesolimab; Registreringsnummer: 400410440225
- Remsima: Aktiv ingrediens: Infliximab; Registreringsnummer: 400410440325
- Soliris: Aktiv ingrediens: Eculizumab; Registreringsnummer: 539410440425
- Flumist: Aktiv ingrediens: Levende influensavaksine (svekket); Registreringsnummer: 001310440525
- Saphnelo: Hovedvirkestoff: Anifrolumab; Registreringsnummer: 870410440625
- Darzalex SC: Aktiv ingrediens: Daratumumab; Registreringsnummer: 760410440725
- Ruxience: Aktiv ingrediens: Rituximab; Registreringsnummer: 540410440825
- Forsteo: Hovedvirkestoff: Teriparatid; Registreringsnummer: 300410440925
- Ocrevus: Aktiv ingrediens: Ocrelizumab; Registreringsnummer: 400410441025
- Bemfola: Hovedvirkestoff: RHFSH (follitropin alfa); Registreringsnummer: 500410441125
- Ziextenzo: Hovedvirkende ingrediens: Pegfilgrastim; Registreringsnummer: 900410441225
- Repatha: Aktiv ingrediens: Evolocumab; Registreringsnummer: 001410441325
Legemiddeltilsynet krever at alle enheter er ansvarlige for at alle legemidler som produseres og leveres til Vietnam, overholder registre og dokumenter som er registrert hos Helsedepartementet . Hvert produkt må ha registreringsnummeret utstedt av Helsedepartementet trykt eller festet til legemiddeletiketten for å sikre åpenhet og sporbarhet.
Disse anleggene må fullt ut overholde vietnamesiske lover og forskrifter fra Helsedepartementet om produksjon, import og sirkulasjon av legemidler. Hvis det skjer endringer knyttet til legemidler under sirkulasjonen i hjemlandet eller i Vietnam, må anlegget umiddelbart rapportere dette til Legemiddeltilsynet i Helsedepartementet.
For legemiddelregistreringsinstitusjoner er det obligatorisk å opprettholde god produksjonspraksis (GMP) for legemiddel- og råvareproduksjonsinstitusjoner. Dersom produksjonsanlegget får sin lisens tilbakekalt eller ikke lenger oppfyller GMP-standardene i hjemlandet, må legemiddelregistreringsinstitusjonen rapportere til Helsedepartementet innen 15 dager fra datoen for mottak av den offisielle varslingen, som foreskrevet i artikkel 98 i dekret 163/2025/ND-CP.
I tillegg må legemiddelproduksjons- og registreringsanlegg koordinere med behandlingsanlegg og forebyggende medisinske fasiliteter for å fullt ut implementere forskrifter om reseptbelagte legemidler, overvåke sikkerhet, effektivitet og uønskede effekter på vietnamesere.
Kilde: https://baolaocai.vn/thuoc-chong-ung-thu-cua-nga-duoc-dang-ky-cap-phep-tai-viet-nam-post886566.html







![[Foto] Statsminister Pham Minh Chinh mottar Laos' arbeids- og velferdsminister Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)































































































![Overgang til Dong Nai OCOP: [Artikkel 3] Kobling av turisme med forbruk av OCOP-produkter](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Kommentar (0)