Nylig har nyheten om at Helsedepartementet har innvilget et registreringsbevis for sirkulasjon i Vietnam for et kreftmedisin kalt Pembroria, utgitt av avisen Dan Tri , fått spesiell oppmerksomhet fra publikum.
Mer spesifikt, i henhold til beslutning nr. 628/QD-QLD datert 31. oktober utstedt av Vietnams legemiddeltilsyn, Helsedepartementet , er legemidlet Pembroria tildelt et registreringsbevis for sirkulasjon i Vietnam med en gyldighet på 3 år.
Pembroria-medisinen har den viktigste aktive ingrediensen pembrolizumab, innhold 100 mg/4 ml, produsert av Limited Liability Company "PK-137" (Russland), tilberedt i form av en konsentrert infusjonsløsning, med en holdbarhet på 24 måneder fra produksjonsdatoen.

Pembroria-medisin har den viktigste aktive ingrediensen pembrolizumab (Foto: incentra).
I tillegg til formen ovenfor, ifølge informasjon fra sirkulasjonsregistreringsanlegget, fremstilles Pembroria også i form av en klar til litt ugjennomsiktig, fargeløs til lysebrun løsning.
Hvilke typer kreft er Pembroria indisert for?
I følge bruksanvisningen fra registreringsorganet er Pembroria indisert for mange typer kreft.
Disse er melanom; ikke-småcellet lungekreft; plateepitelkarsinom i hode og nakke; klassisk Hodgkins lymfom; urotelial kreft; spiserørskreft; kolorektal kreft; ikke-kolorektal kreft; livmorhals- og endometriekreft; nyrecellekarsinom; trippel-negativ brystkreft; adenokarsinom i magesekken eller gastroøsofageal overgang; og kolangiokarsinom.
Avhengig av krefttype og sykdomsstadium (tidlig eller metastatisk), vil Pembroria bli foreskrevet i ulike aldre, brukt som monoterapi eller i kombinasjon med cellegift og andre legemidler.
Dette legemidlet brukes både poliklinisk og på sykehus. Behandlingen må igangsettes og overvåkes av erfarne onkologer.
For å få forskrevet legemidlet ovenfor, må pasientene utføre PD-L1-testing (immunhistokjemisk testing for å måle mengden PD-L1-protein på overflaten av kreftceller), testing for å bestemme tumorstatus for mikrosatellittinstabilitet (MSI) eller mismatch-reparasjonsmangel (MMR).
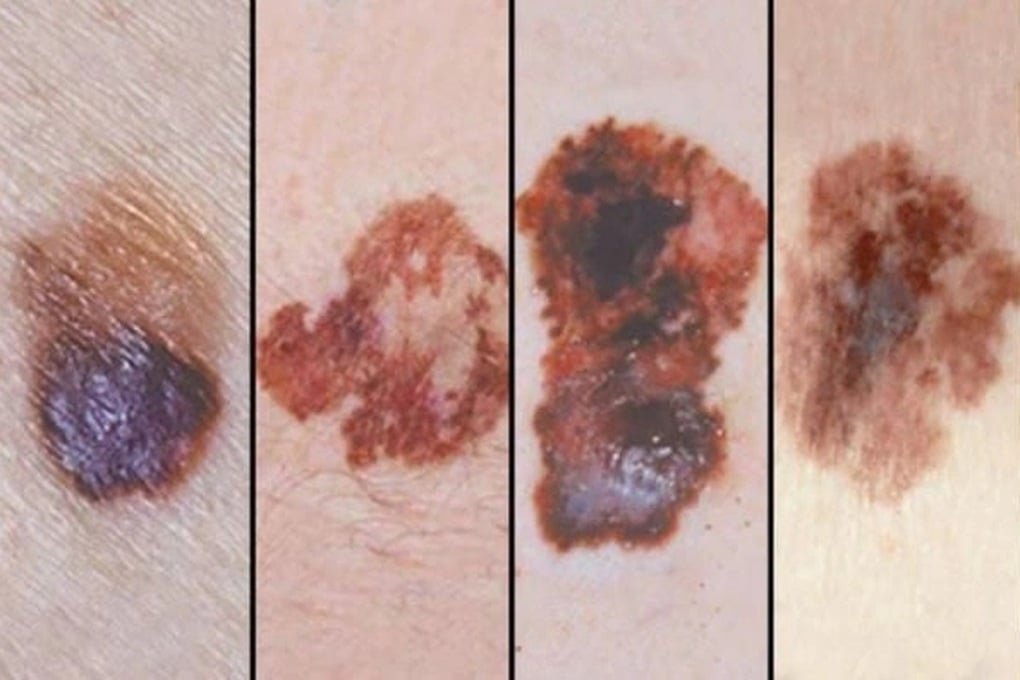
Malignt melanom er en av sykdommene som kan behandles med Pembrolizumab (Foto: BV).
Merknader ved bruk
Når det gjelder dosering, er anbefalt dose av Pembrolizumab for voksne 200 mg hver 3. uke eller 400 mg hver 6. uke, gitt som en intravenøs infusjon.
Anbefalt dose av Pembrolizumab som monoterapi hos pediatriske pasienter 3 år og eldre (med klassisk Hodgkins lymfom) eller pasienter 12 år og eldre (med melanom) er 2 mg/kg kroppsvekt (maksimalt 200 mg) administrert som intravenøs infusjon hver 3. uke.
Når det gjelder kombinasjonsbruk, vil det avhenge av produktets egenskaper og samtidige behandlinger.
Avhengig av krefttypen anbefales pasienter å motta pembrolizumab-behandling inntil det er tegn på sykdomsprogresjon eller uakseptabel toksisitet.

Kreftpasienter som får behandling på Cho Ray sykehus (Foto: Hoang Le).
Ved adjuvant behandling av visse kreftformer (som melanom, ikke-småcellet lungekarsinom eller nyrecellekarsinom) anbefales pembrolizumab av produsenten inntil sykdomsrecidiv, uakseptabel toksisitet eller i opptil 1 år ...
I tillegg til behandlingsindikasjoner må pasienter også være oppmerksomme på uønskede immunrelaterte reaksjoner ved bruk av Pembroria for å få passende justeringer, midlertidig stoppe bruken eller stoppe på ubestemt tid.
Spesielt kan pasienter oppleve tilstander som lungebetennelse (grad 2-3), kolitt (grad 2-3), nefritt, endokrine sykdommer, hepatitt, alvorlige subkutane reaksjoner...
Hvis pasienten utvikler myokarditt, encefalitt, Guillain-Barré syndrom (akutt polynevropati) eller alvorlige reaksjoner etter injeksjon (grad 3-4), må behandlingen med dette legemidlet seponeres permanent.
I tillegg er ikke sikkerheten og effekten av pembrolizumab hos personer under 18 år fastslått (unntatt hos pediatriske pasienter med melanom og klassisk Hodgkins lymfom). Det anbefales også at legemidlet administreres intravenøst over 30 minutter, ikke ved rask intravenøs injeksjon eller intravenøs bolusinjeksjon.
Innvilgelse av sirkulasjonsregistrering for å utføre klinisk forskning
I paragraf 5, artikkel 2 (om produksjonsanleggets og legemiddelregistreringsanleggets ansvar) i beslutning nr. 628/QD-QLD utstedt 31. oktober, uttalte Vietnams legemiddeltilsyn, helsedepartementet, at med legemiddel nr. 1 i tillegget til denne beslutningen (Pembroria), etter å ha fått innvilget et registreringsbevis for sirkulasjon, må selskapet regelmessig oppdatere fremdriften i implementeringen av klinisk forskning, overvåke fase III-immunogenisitet og sende inn dokumenter for å endre og supplere de oppdaterte dataene om fase III-immunogenisitetsovervåking når forskningsperioden avsluttes.
Ifølge informasjon fra Legemiddeltilsynet er Pembroria et monoklonalt antistoff, produsert basert på det originale referansebiologiske produktet fra legemiddelselskapet MSD (USA). Siden 2017 har Keytruda – et annet legemiddel med den viktigste aktive ingrediensen Pembrolizumab – vært godkjent for sirkulasjon i Vietnam.
Kilde: https://dantri.com.vn/suc-khoe/thuoc-pembroria-cua-nga-duoc-chi-dinh-cho-cac-loai-ung-thu-gi-20251111231728560.htm





![[Foto] Statsminister Pham Minh Chinh mottar Laos' arbeids- og velferdsminister Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)




























































































![Overgang til Dong Nai OCOP: [Artikkel 3] Kobling av turisme med forbruk av OCOP-produkter](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Kommentar (0)