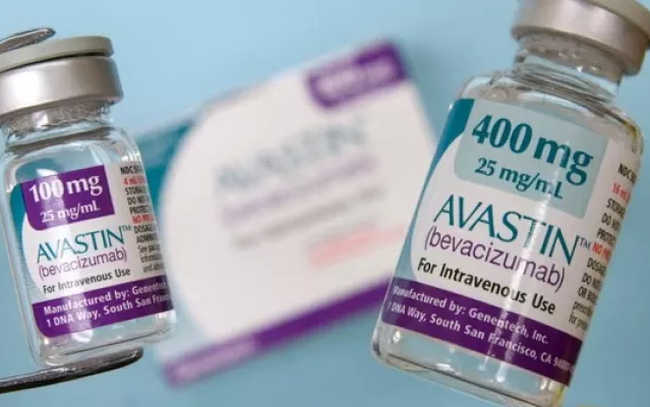
Pakistan prowadzi dochodzenie w sprawie dwóch dystrybutorów szwajcarskiego leku przeciwnowotworowego Avastin firmy Roche po tym, jak 12 pacjentów z cukrzycą straciło wzrok po otrzymaniu zastrzyków z lekiem. Avastin jest również dopuszczony do obrotu w Wietnamie.
W Wietnamie, do 27 września, Wietnamska Agencja ds. Leków ( Ministerstwo Zdrowia ) nie otrzymała żadnych raportów o niepożądanych skutkach ubocznych leku Avastin u pacjentów, u których doszło do utraty wzroku w wyniku stosowania tego leku.
Wietnamska Agencja ds. Leków otrzymała raport z Biura Przedstawicielskiego F. Hoffmann La Roche Ltd. na temat tego incydentu.
W Pakistanie około 12 pacjentów straciło wzrok po zastrzykach dostarczonych przez nielegalnego dostawcę Genius Pharmaceutical Service. Lek oznaczono jako „Inj. Avastin 1,25 mg/0,05 ml”, co wywołało błędne wrażenie, że jest to produkt firmy Roche.
Avastin firmy Roche nie jest zatwierdzony do stosowania w okulistyce. Firma Genius Pharmaceutical Service dostarczyła/rozcieńczyła/przepakowała dawkę 1,25 mg/0,5 ml w niehigienicznych i niezatwierdzonych warunkach.
Władze Pakistanu badają przyczynę skażenia. Możliwe przyczyny to niewłaściwa sterylizacja, skażone fiolki, niesterylne strzykawki oraz odstępstwa od standardowych procedur operacyjnych podczas wydawania leków.
Jednocześnie rząd Pakistanu zażądał wycofania z obrotu 3 partii leku Avastin 100 mg/ml (H352B11, B7266B07, B7266B20) firmy Roche oraz wszystkich leków dostarczonych przez firmę Genius Pharmaceutical Service.
(Ilustracja: 24 News HD).
W Wietnamie lek Avastin (substancja czynna Bevacizumab) uzyskał 4 certyfikaty rejestracji do obrotu, z których wszystkie są nadal ważne. W tym:
Bevacizumab 100 mg/4 ml (pudełko zawierające 1 fiolkę x 4 ml; numer rejestracyjny: 400410250123 (QLSP-1118-18); producent: Roche Diagnostics GmbH, Niemcy).
Bevacizumab 400 mg/16 ml (pudełko zawierające 1 fiolkę x 16 ml: numer rejestracyjny: 400410250223 (QLSP-1119-18); producent: Roche Diagnostics GmbH, Niemcy).
Bevacizumab 100 mg/4 ml (pudełko zawierające 1 fiolkę x 16 ml; numer rejestracyjny: QLSP-1010-17; producent: F. Hoffmann-La Roche Ltd., Szwajcaria).
Bevacizumab 400 mg/16 ml (pudełko zawierające 1 fiolkę x 16 ml; numer rejestracyjny: QLSP-1011-17; producent: F. Hoffmann-La Roche Ltd., Szwajcaria).
Avastin jest dopuszczony w Wietnamie do leczenia niektórych nowotworów, w tym przerzutowego raka jelita grubego, zaawansowanego, przerzutowego lub nawracającego niedrobnokomórkowego raka płuc, zaawansowanego i/lub przerzutowego raka nerkowokomórkowego, glejaka wielopostaciowego/glejaka złośliwego (stopień IV według WHO), raka nabłonkowego jajnika, raka jajowodu i pierwotnego raka otrzewnej.
Oprócz ogólnych ostrzeżeń ulotka dołączona do opakowania, zatwierdzona przez FDA, zawiera ostrzeżenie: „nie stosować doszklistkowo”.
Lek może powodować zaburzenia widzenia. Zgłaszano pojedyncze przypadki i skupiska poważnych działań niepożądanych ze strony oczu po wstrzyknięciu doszklistkowym, niezatwierdzonej drodze podawania mieszanin Avastinu z fiolek przeznaczonych do wlewów dożylnych u pacjentów onkologicznych.
Do reakcji tych zalicza się zakażenie wewnątrzgałkowe, zapalenie wnętrza gałki ocznej, zapalenie błony naczyniowej oka, odwarstwienie siatkówki, przedarcie nabłonka barwnikowego siatkówki, jaskrę, krwotok wewnątrzgałkowy. Niektóre z tych zdarzeń powodują różnego stopnia utratę pola widzenia, w tym trwałą ślepotę .
Źródło



![[Zdjęcie] Premier Pham Minh Chinh przewodniczy drugiemu spotkaniu Komitetu Sterującego ds. rozwoju gospodarki prywatnej.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/01/1762006716873_dsc-9145-jpg.webp)









































































































Komentarz (0)