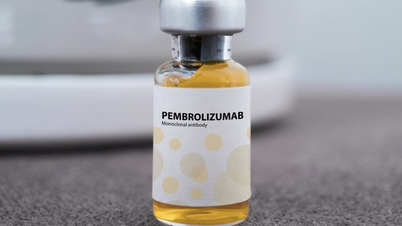
Wietnamska Agencja ds. Leków ( Ministerstwo Zdrowia ) wydała certyfikat rejestracji do obrotu w Wietnamie dla leku Pembroria, produkowanego w Rosji, z ponad 14 wskazaniami do leczenia różnych typów raka.
W tym przypadku Pembroria (głównym składnikiem aktywnym jest pembrolizumab o stężeniu 100 mg/4 ml) jest produkowana przez spółkę z ograniczoną odpowiedzialnością „PK-137” (Rosja). Jednostka rejestrująca: Anabion Pharmaceutical Trading Ltd, Zjednoczone Emiraty Arabskie. Pembroria jest przygotowywana w postaci skoncentrowanego roztworu do infuzji, z okresem ważności 24 miesięcy od daty produkcji. Opakowanie: 1 butelka x 4 ml.
Substancja czynna pembrolizumab ma ponad 14 wskazań do leczenia różnych typów nowotworów (takich jak rak płuc, czerniak, rak jelita grubego, rak szyjki macicy, rak nerkowokomórkowy, rak piersi...).
Decyzja 628/QD-QLD wyraźnie stanowi, że placówki zajmujące się produkcją i rejestracją leków są odpowiedzialne za: produkcję i dostarczanie leków do Wietnamu zgodnie z zapisami i dokumentami zarejestrowanymi w Ministerstwie Zdrowia .
Zakład rejestracji leków musi złożyć Ministerstwu Zdrowia raport dotyczący przestrzegania dobrych praktyk produkcyjnych przez zakład produkujący leki i składniki leków. W przypadku cofnięcia licencji produkcyjnej lub nieprzestrzegania przez zakład produkcyjny dobrych praktyk produkcyjnych leków i składników leków w kraju macierzystym, zakład musi złożyć raport w ciągu 15 dni od daty powiadomienia przez właściwy organ zarządzający kraju macierzystego.
Jednocześnie należy współpracować z placówkami leczniczymi i placówkami medycyny profilaktycznej w celu przestrzegania obowiązujących przepisów dotyczących leków na receptę, monitorować bezpieczeństwo, skuteczność i niepożądane skutki leków na obywateli Wietnamu oraz sporządzać sprawozdania zgodnie z przepisami.
Wietnamska Agencja ds. Leków wymaga, aby po otrzymaniu certyfikatu rejestracji leku w obrocie, firma okresowo aktualizowała postęp badań klinicznych dotyczących monitorowania immunogenności fazy III co 3 miesiące od daty wydania certyfikatu rejestracji leku w obrocie oraz składała dokumenty w celu zmiany i aktualizacji danych monitorowania immunogenności fazy III po zakończeniu okresu badawczego.
Source: https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html






![[Zdjęcie] Premier Pham Minh Chinh przyjmuje laotańskiego ministra pracy i opieki społecznej Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)






![[Wideo] Wiele przedmiotów ulega degradacji, ponieważ dwa duże szpitale są powoli oddawane do użytku](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762906839099_dung00-29-15-18still010-jpg.webp)




![[Wideo] Chu Nhat Quang – Od „świętego znaku” do rekordu świata](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762909239247_2385424671828914264-8140-jpg.webp)

![[Wideo] Projekty dokumentów XIV Kongresu Narodowego podkreślają kluczową rolę polityki zagranicznej](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762905940110_dung00-24-48-14still009-jpg.webp)



































































![Przejście Dong Nai OCOP: [Artykuł 3] Powiązanie turystyki z konsumpcją produktów OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Komentarz (0)