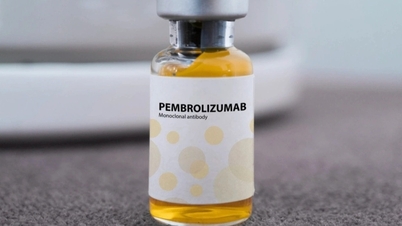
A Administração de Medicamentos do Vietnã ( Ministério da Saúde ) concedeu um certificado de registro de circulação no Vietnã para o medicamento Pembroria, produzido na Rússia, que possui mais de 14 indicações para diferentes tipos de câncer.
O Pembroria (cujo principal ingrediente ativo é o Pembrolizumabe, na concentração de 100 mg/4 ml) é produzido pela empresa de responsabilidade limitada "PK-137" (Rússia). O registro do medicamento está a cargo da Anabion Pharmaceutical Trading Ltd, nos Emirados Árabes Unidos. O Pembroria é apresentado na forma de solução concentrada para infusão, com prazo de validade de 24 meses a partir da data de fabricação. Embalagem: 1 frasco de 4 ml.
O princípio ativo Pembrolizumab possui mais de 14 indicações para diferentes tipos de câncer (como carcinoma pulmonar, melanoma, câncer colorretal, câncer cervical, carcinoma de células renais, câncer de mama...).
A Decisão 628/QD-QLD afirma claramente que os estabelecimentos de fabricação e registro de medicamentos são responsáveis por: Produzir e fornecer medicamentos ao Vietnã de acordo com os registros e documentos cadastrados no Ministério da Saúde .
A unidade de registro de medicamentos deve informar ao Ministério da Saúde sobre a manutenção da conformidade com as boas práticas de fabricação do medicamento e dos ingredientes farmacêuticos. Caso a licença de fabricação da unidade seja revogada ou ela não esteja em conformidade com as boas práticas de fabricação de medicamentos e ingredientes farmacêuticos em seu país de origem, a unidade deverá apresentar um relatório no prazo de 15 dias a partir da data da notificação pela agência reguladora competente do país de origem.
Ao mesmo tempo, coordenar com centros de tratamento e serviços de medicina preventiva para cumprir as normas vigentes sobre medicamentos prescritos, monitorar a segurança, a eficácia e os efeitos indesejáveis dos medicamentos na população vietnamita, e sintetizar e relatar as informações de acordo com as regulamentações.
A Administração de Medicamentos do Vietnã exige que, após a concessão do certificado de registro de circulação do medicamento, a empresa atualize periodicamente o progresso da pesquisa clínica de fase III de monitoramento da imunogenicidade a cada 3 meses a partir da data de emissão do certificado de registro de circulação do medicamento e apresente documentos para alterar e atualizar os dados de monitoramento da imunogenicidade de fase III ao término do período de pesquisa.
Fonte: https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html





![[Foto] O primeiro-ministro Pham Minh Chinh recebe o ministro do Trabalho e Bem-Estar do Laos, Phosay Sayasone.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)






















































































![Transição OCOP de Dong Nai: [Artigo 3] Vinculando o turismo ao consumo de produtos OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Comentário (0)