Pe 11 noiembrie, Administrația Medicamentelor din Vietnam, Ministerul Sănătății, a anunțat că tocmai a emis Decizia nr. 628/QD-QLD din data de 31 octombrie privind 14 vaccinuri și produse biologice pentru care s-a acordat înregistrarea pentru circulație în Vietnam.
Printre acestea se numără medicamentul Pembroria (principalul ingredient activ este Pembrolizumab, conținut 100 mg/4 ml), produs de Societatea cu Răspundere Limitată „PK-137” (Rusia), înregistrată la o fabrică din Emiratele Arabe Unite.
Medicamentul Pembroria este preparat sub formă de soluție concentrată pentru perfuzie, cu o durată de valabilitate de 24 de luni de la data fabricației.
Pembrolizumab are în prezent peste 14 indicații pentru diferite tipuri de cancer (cum ar fi carcinomul pulmonar, melanomul, cancerul colorectal, cancerul de col uterin, carcinomul renal, cancerul de sân...).
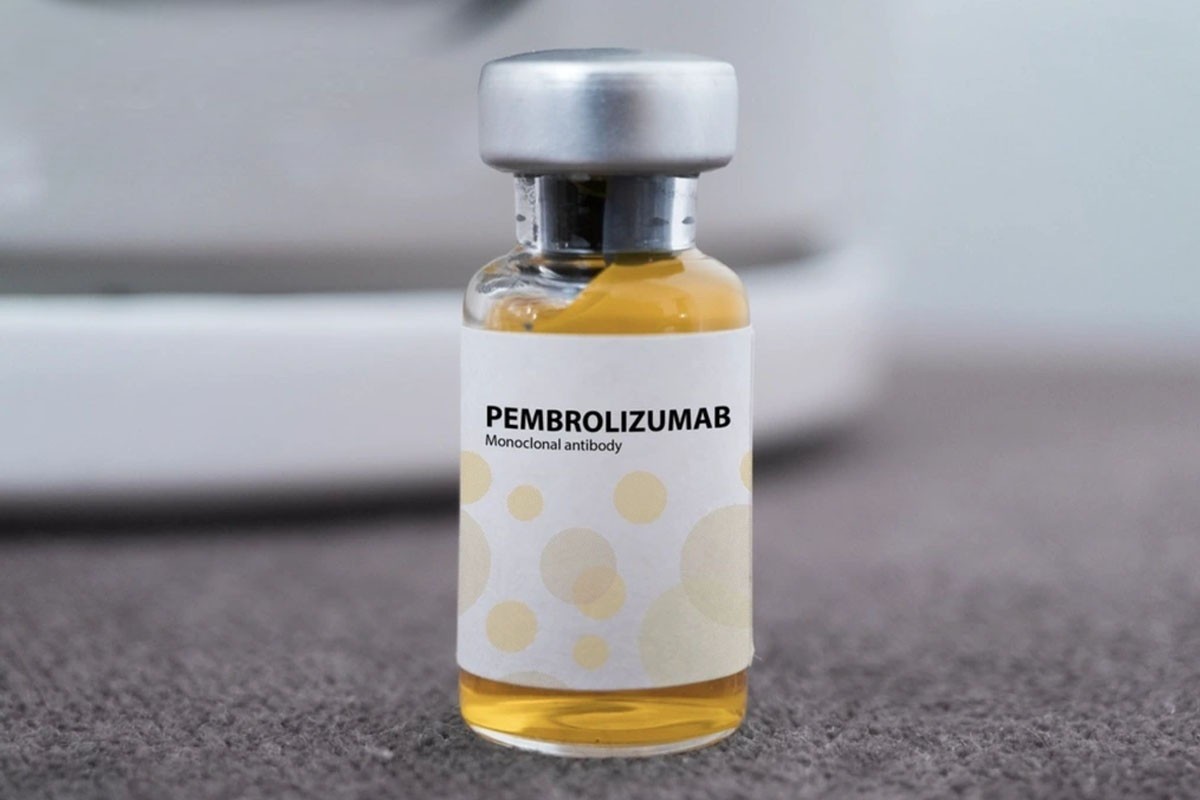
Medicamentul Pembroria are ca principal ingredient activ pembrolizumab.
Conform Administrației Medicamentelor, după acordarea unui certificat de înregistrare a circulației, compania trebuie să actualizeze periodic progresul cercetării clinice privind monitorizarea imunogenității fazei III la fiecare 3 luni de la data emiterii certificatului de înregistrare a circulației. Să depună documente pentru modificarea și actualizarea datelor privind monitorizarea imunogenității fazei III la sfârșitul perioadei de cercetare.
Pe lângă Pembroria, vaccinurile și produsele biologice cărora li s-au acordat certificate de înregistrare a circulației includ:
- Metalyse: Principalul ingredient activ: Tenecteplază; Număr de înregistrare: 400410440125
- Spevigo: Substanță activă: Spesolimab; Număr de înregistrare: 400410440225
- Remsima: Substanță activă: Infliximab; Număr de înregistrare: 400410440325
- Soliris: Substanță activă: Eculizumab; Număr de înregistrare: 539410440425
- Flumist: Substanță activă: Vaccin antigripal viu (atenuat); Număr de înregistrare: 001310440525
- Saphnelo: Ingredient activ principal: Anifrolumab; Număr de înregistrare: 870410440625
- Darzalex SC: Ingredient activ: Daratumumab; Număr de înregistrare: 760410440725
- Ruxience: Substanță activă: Rituximab; Număr de înregistrare: 540410440825
- Forsteo: Principalul ingredient activ: Teriparatidă; Număr de înregistrare: 300410440925
- Ocrevus: Substanță activă: Ocrelizumab; Număr de înregistrare: 400410441025
- Bemfola: Ingredient activ principal: RHFSH (folitropină alfa); Număr de înregistrare: 500410441125
- Ziextenzo: Substanță activă principală: Pegfilgrastim; Număr de înregistrare: 900410441225
- Repatha: Substanță activă: Evolocumab; Număr de înregistrare: 001410441325
Administrația Medicamentelor solicită tuturor unităților să fie responsabile pentru toate medicamentele produse și furnizate Vietnamului, în conformitate cu înregistrările și documentele înregistrate la Ministerul Sănătății . Fiecare produs trebuie să aibă numărul de înregistrare emis de Ministerul Sănătății tipărit sau aplicat pe eticheta medicamentului pentru a asigura transparența și trasabilitatea.
Aceste unități trebuie să respecte pe deplin legile și reglementările vietnameze ale Ministerului Sănătății privind producția, importul și circulația medicamentelor. Dacă există modificări legate de medicamente în timpul circulației în țara de origine sau în Vietnam, unitatea trebuie să raporteze imediat Administrației Medicamentelor din cadrul Ministerului Sănătății.
Pentru unitățile de înregistrare a medicamentelor, menținerea unor bune practici de fabricație (BPF) în cadrul unităților de producție a medicamentelor și materiilor prime este obligatorie. În cazul în care unității de producție i se revocă licența sau nu mai îndeplinește standardele BPF din țara de origine, unitatea de înregistrare a medicamentelor trebuie să raporteze Ministerului Sănătății în termen de 15 zile de la data primirii notificării oficiale, așa cum este prevăzut la articolul 98 din Decretul 163/2025/ND-CP.
În plus, unitățile de producție și înregistrare a medicamentelor trebuie să se coordoneze cu unitățile de tratament și unitățile medicale preventive pentru a implementa pe deplin reglementările privind medicamentele eliberate pe bază de rețetă, a monitoriza siguranța, eficacitatea și efectele nedorite asupra vietnamezilor.
Sursă: https://baolaocai.vn/thuoc-chong-ung-thu-cua-nga-duoc-dang-ky-cap-phep-tai-viet-nam-post886566.html



![[Foto] Prim-ministrul Pham Minh Chinh îl primește pe ministrul Muncii și Bunăstării Sociale din Laos, Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)



































































































![Tranziția Dong Nai OCOP: [Articolul 3] Legarea turismului cu consumul de produse OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Comentariu (0)