Recent, vestea că Ministerul Sănătății a acordat un certificat de înregistrare a circulației în Vietnam pentru un medicament anticancerigen numit Pembroria, publicată de ziarul Dan Tri , a atras o atenție deosebită din partea publicului.
Mai exact, conform Deciziei nr. 628/QD-QLD din 31 octombrie, emisă de Administrația Medicamentelor din Vietnam, Ministerul Sănătății , medicamentului Pembroria i s-a acordat un certificat de înregistrare a circulației în Vietnam, cu o valabilitate de 3 ani.
Medicamentul Pembroria are ca ingredient activ principal Pembrolizumab, cu un conținut de 100 mg/4 ml, produs de Societatea cu Răspundere Limitată „PK-137” (Rusia), preparat sub formă de soluție perfuzabilă concentrată, cu un termen de valabilitate de 24 de luni de la data fabricației.

Medicamentul Pembroria are ca principal ingredient activ Pembrolizumab (Foto: incentra).
Pe lângă forma menționată mai sus, conform informațiilor furnizate de centrul de înregistrare a circulației, Pembroria este preparată și sub formă de soluție limpede până la ușor opacă, incoloră până la maro deschis.
Pentru ce tipuri de cancer este indicat Pembroria?
Conform instrucțiunilor de utilizare de la agenția de înregistrare, Pembroria este indicată pentru multe tipuri de cancer.
Acestea sunt melanomul; cancerul pulmonar fără celule mici; carcinomul scuamos al capului și gâtului; limfomul Hodgkin clasic; cancerul urotelial; cancerul esofagian; cancerul colorectal; cancerul non-colorectal; cancerul de col uterin și endometrial; carcinomul renal; cancerul mamar triplu negativ; adenocarcinomul stomacului sau al joncțiunii gastroesofagiene; și colangiocarcinomul.
În funcție de tipul de cancer și de stadiul bolii (incipient sau metastatic), Pembroria va fi prescrisă la diferite vârste, utilizată ca monoterapie sau în combinație cu chimioterapie și alte medicamente.
Acest medicament este utilizat atât în ambulatoriu, cât și în spital. Tratamentul trebuie inițiat și supravegheat de oncologi cu experiență.
Pentru a li se prescrie medicamentul menționat mai sus, pacienții trebuie să efectueze testul PD-L1 (test imunohistochimic pentru măsurarea cantității de proteină PD-L1 de pe suprafața celulelor canceroase), testare pentru a determina starea tumorii de instabilitate a microsateliților (MSI) sau deficit de reparare a erorilor de tip misplay (MMR).
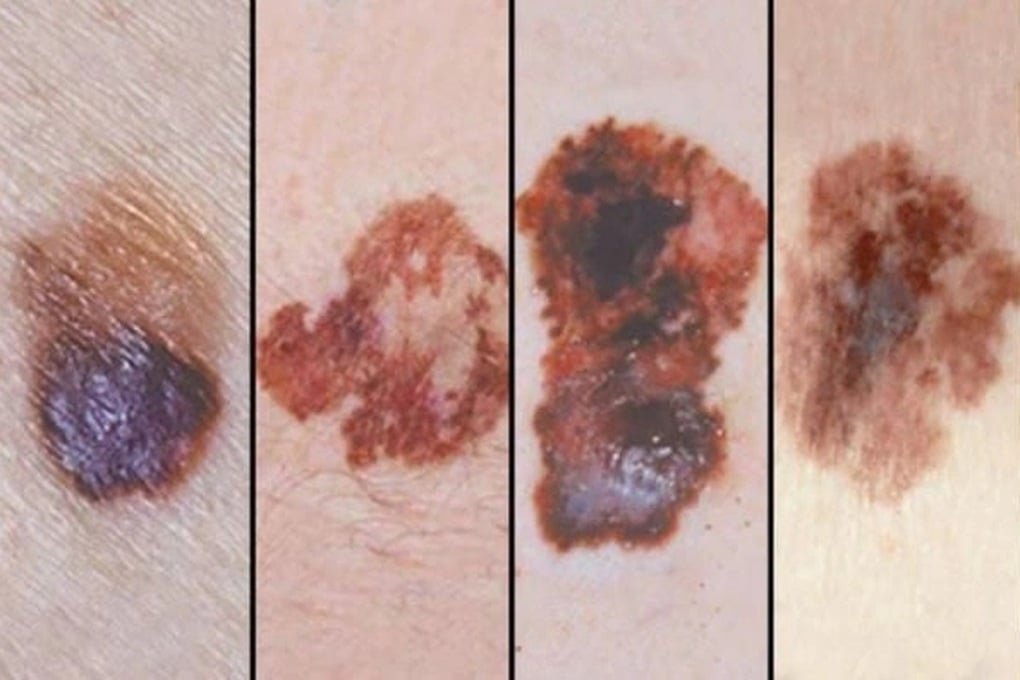
Melanomul malign este una dintre bolile care pot fi tratate cu Pembrolizumab (Foto: BV).
Note privind utilizarea
În ceea ce privește dozajul, doza recomandată de Pembrolizumab la adulți este de 200 mg la fiecare 3 săptămâni sau 400 mg la fiecare 6 săptămâni, administrată sub formă de perfuzie intravenoasă.
Doza recomandată de Pembrolizumab în monoterapie la pacienții copii cu vârsta de 3 ani și peste (cu limfom Hodgkin clasic) sau la pacienții cu vârsta de 12 ani și peste (cu melanom) este de 2 mg/kg greutate corporală (maximum 200 mg) administrată în perfuzie intravenoasă la fiecare 3 săptămâni.
În ceea ce privește utilizarea în combinație, aceasta va depinde de proprietățile produsului și de terapiile concomitente.
În funcție de tipul de cancer, pacienților li se recomandă să primească tratament cu Pembrolizumab până când există dovezi de progresie a bolii sau de toxicitate inacceptabilă.

Pacienți cu cancer primind tratament la Spitalul Cho Ray (Foto: Hoang Le).
În tratamentul adjuvant al anumitor tipuri de cancer (cum ar fi melanomul, carcinomul pulmonar fără celule mici sau carcinomul renal), pembrolizumab este recomandat de producător până la recurența bolii, toxicitate inacceptabilă sau timp de până la 1 an...
Pe lângă indicațiile de tratament, pacienții trebuie să acorde atenție și reacțiilor adverse legate de imunitate atunci când utilizează Pembroria, pentru a efectua ajustările adecvate, a opri temporar utilizarea sau a o opri pe termen nelimitat.
Mai exact, pacienții pot prezenta afecțiuni precum pneumonie (gradul 2-3), colită (gradul 2-3), nefrită, boli endocrine, hepatită, reacții adverse subcutanate severe...
Dacă pacientul dezvoltă miocardită, encefalită, sindrom Guillain-Barre (polineuropatie acută) sau reacții post-injectare severe (gradul 3-4), tratamentul cu acest medicament trebuie întrerupt definitiv.
În plus, siguranța și eficacitatea pembrolizumab la persoanele cu vârsta sub 18 ani nu au fost stabilite (cu excepția pacienților pediatrici cu melanom și limfom Hodgkin clasic). De asemenea, se recomandă ca medicamentul să fie administrat intravenos pe parcursul a 30 de minute, nu prin injecție intravenoasă rapidă sau injecție intravenoasă în bolus.
Acordarea înregistrării de circulație pentru efectuarea de cercetări clinice
În Secțiunea 5, Articolul 2 (privind responsabilitățile unității de producție și ale unității de înregistrare a medicamentelor) din Decizia nr. 628/QD-QLD emisă la 31 octombrie, Administrația Medicamentelor din Vietnam, Ministerul Sănătății, a declarat că, în cazul medicamentului nr. 1 din Anexa acestei Decizii (Pembroria), după acordarea unui certificat de înregistrare a circulației, compania trebuie să actualizeze periodic progresul implementării cercetării clinice, să monitorizeze imunogenitatea fazei III și să prezinte documente pentru modificarea, completarea și actualizarea datelor de monitorizare a imunogenității fazei III la încheierea perioadei de cercetare.
Conform informațiilor de la Administrația Medicamentelor, Pembroria este un anticorp monoclonal, produs pe baza produsului biologic de referință original al companiei farmaceutice MSD (SUA). Din 2017, Keytruda - un alt medicament cu principalul ingredient activ Pembrolizumab - este autorizat pentru circulație în Vietnam.
Sursă: https://dantri.com.vn/suc-khoe/thuoc-pembroria-cua-nga-duoc-chi-dinh-cho-cac-loai-ung-thu-gi-20251111231728560.htm





![[Foto] Prim-ministrul Pham Minh Chinh îl primește pe ministrul Muncii și Bunăstării Sociale din Laos, Phosay Sayasone](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)




























































































![Tranziția Dong Nai OCOP: [Articolul 3] Legarea turismului cu consumul de produse OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Comentariu (0)