Недавно новость о том, что Министерство здравоохранения выдало сертификат на регистрацию обращения во Вьетнаме противоракового препарата под названием «Пембрория», опубликованная в газете Dan Tri , привлекла особое внимание общественности.
В частности, в соответствии с Решением № 628/QD-QLD от 31 октября, вынесенным Управлением по лекарственным средствам Министерства здравоохранения Вьетнама, лекарственному препарату Пембрория выдано удостоверение на регистрацию обращения во Вьетнаме сроком на 3 года.
Препарат Пембролия содержит основное действующее вещество пембролизумаб в концентрации 100 мг/4 мл, производства ООО «ПК-137» (Россия), приготовленный в форме концентрированного раствора для инфузий, со сроком годности 24 месяца со дня изготовления.

Препарат Пембролия содержит основное действующее вещество пембролизумаб (Фото: incentra).
Помимо вышеуказанной формы, по информации органа регистрации обращения, пембрория также выпускается в виде прозрачного или слегка непрозрачного, бесцветного или светло-коричневого раствора.
При каких видах рака показан препарат Пембрория?
Согласно инструкции по применению регистрационного агентства, Пембрория показана при многих видах рака.
К ним относятся меланома; немелкоклеточный рак легких; плоскоклеточный рак головы и шеи; классическая лимфома Ходжкина; уротелиальный рак; рак пищевода; колоректальный рак; неколоректальный рак; рак шейки матки и эндометрия; почечно-клеточный рак; трижды негативный рак молочной железы; аденокарцинома желудка или гастроэзофагеального перехода; холангиокарцинома.
В зависимости от типа рака и стадии заболевания (ранняя или метастатическая) Пембрория будет назначаться в разном возрасте, использоваться в качестве монотерапии или в сочетании с химиотерапией и другими препаратами.
Этот препарат применяется как амбулаторно, так и в стационарных условиях. Лечение должно проводиться под наблюдением опытных онкологов.
Для назначения вышеуказанного препарата пациентам необходимо пройти тестирование на PD-L1 (иммуногистохимическое исследование для измерения количества белка PD-L1 на поверхности раковых клеток), а также тестирование на определение статуса опухоли по микросателлитной нестабильности (MSI) или дефициту репарации несоответствий (MMR).
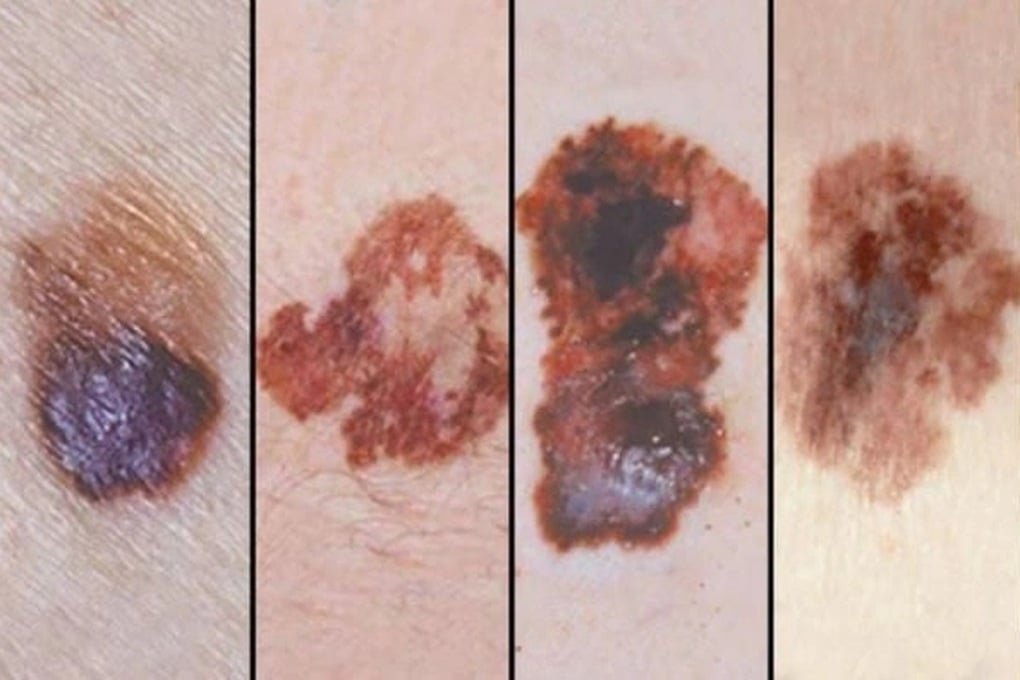
Злокачественная меланома — одно из заболеваний, которое можно лечить пембролизумабом (Фото: BV).
Примечания при использовании
Что касается дозировки, рекомендуемая доза пембролизумаба для взрослых составляет 200 мг каждые 3 недели или 400 мг каждые 6 недель в виде внутривенной инфузии.
Рекомендуемая доза пембролизумаба в качестве монотерапии у детей в возрасте от 3 лет и старше (с классической лимфомой Ходжкина) или пациентов в возрасте от 12 лет и старше (с меланомой) составляет 2 мг/кг массы тела (максимум 200 мг) в виде внутривенной инфузии каждые 3 недели.
Что касается комбинированного применения, то оно будет зависеть от свойств продукта и сопутствующей терапии.
В зависимости от типа рака пациентам рекомендуется получать лечение пембролизумабом до тех пор, пока не появятся признаки прогрессирования заболевания или неприемлемой токсичности.

Онкологические больные проходят лечение в больнице Чо Рэй (Фото: Хоанг Ле).
При адъювантной терапии некоторых видов рака (таких как меланома, немелкоклеточный рак легкого или почечноклеточный рак) производитель рекомендует применять пембролизумаб до рецидива заболевания, возникновения неприемлемой токсичности или в течение периода до 1 года…
Помимо показаний к лечению, пациентам также необходимо обращать внимание на побочные реакции со стороны иммунной системы при использовании препарата Пембрория, чтобы внести соответствующие коррективы, временно прекратить использование или прекратить его на неопределенный срок.
В частности, у пациентов могут возникнуть такие состояния, как пневмония (2-3 степени), колит (2-3 степени), нефрит, эндокринные заболевания, гепатит, тяжелые подкожные реакции...
Если у пациента разовьется миокардит, энцефалит, синдром Гийена-Барре (острая полинейропатия) или тяжелые постинъекционные реакции (3-4 степени), лечение данным препаратом необходимо окончательно прекратить.
Кроме того, безопасность и эффективность пембролизумаба у лиц младше 18 лет не установлены (за исключением детей с меланомой и классической лимфомой Ходжкина). Препарат рекомендуется вводить внутривенно в течение 30 минут, а не путем быстрой внутривенной инъекции или внутривенного болюса.
Предоставление регистрации обращения для проведения клинических исследований
В Разделе 5, Статьи 2 (об обязанностях производственного предприятия и центра регистрации лекарственных средств) Решения № 628/QD-QLD, выпущенного 31 октября, Управление по лекарственным средствам Вьетнама, Министерство здравоохранения заявило, что в отношении препарата № 1, указанного в Приложении к настоящему Решению (Пембрория), после получения свидетельства о регистрации обращения компания должна периодически обновлять ход реализации клинических исследований, контролировать иммуногенность фазы III и представлять документы для изменения и дополнения, а также обновлять данные мониторинга иммуногенности фазы III по окончании периода исследований.
Согласно информации Управления по контролю за лекарственными средствами, препарат «Пембрория» представляет собой моноклональное антитело, созданное на основе оригинального референтного биологического препарата фармацевтической компании MSD (США). С 2017 года во Вьетнаме разрешен к применению препарат «Кейтруда» – другой препарат с основным действующим веществом пембролизумабом.
Источник: https://dantri.com.vn/suc-khoe/thuoc-pembroria-cua-nga-duoc-chi-dinh-cho-cac-loai-ung-thu-gi-20251111231728560.htm





![[Фото] Премьер-министр Фам Минь Чинь принимает министра труда и благосостояния Лаоса Пхосея Саясона](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)



























































































![Переход Донгнай OCOP: [Статья 3] Связь туризма с потреблением продукции OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Комментарий (0)