เมื่อวันที่ 11 พฤศจิกายน สำนักงานคณะกรรมการอาหารและยาแห่งเวียดนาม กระทรวงสาธารณสุข ประกาศว่าเพิ่งออกคำสั่งหมายเลข 628/QD-QLD ลงวันที่ 31 ตุลาคม เกี่ยวกับวัคซีนและผลิตภัณฑ์ทางชีวภาพ 14 รายการที่ได้รับอนุมัติให้ขึ้นทะเบียนเพื่อจำหน่ายในเวียดนาม
ในจำนวนนี้ มียา Pembroria (ตัวยาสำคัญหลักคือ Pembrolizumab ปริมาณ 100 มก./4 มล.) ผลิตโดยบริษัทจำกัดความรับผิด "PK-137" (รัสเซีย) ซึ่งจดทะเบียนกับโรงงานแห่งหนึ่งในสหรัฐอาหรับเอมิเรตส์
ยาเพมโบรเรียเตรียมในรูปแบบสารละลายเข้มข้นสำหรับการแช่ โดยมีอายุการเก็บรักษา 24 เดือนนับจากวันที่ผลิต
ปัจจุบัน Pembrolizumab มีข้อบ่งชี้ในการรักษามะเร็งหลายประเภทมากกว่า 14 รายการ (เช่น มะเร็งปอด มะเร็งผิวหนัง มะเร็งลำไส้ใหญ่และทวารหนัก มะเร็งปากมดลูก มะเร็งเซลล์ไต มะเร็งเต้านม ฯลฯ)
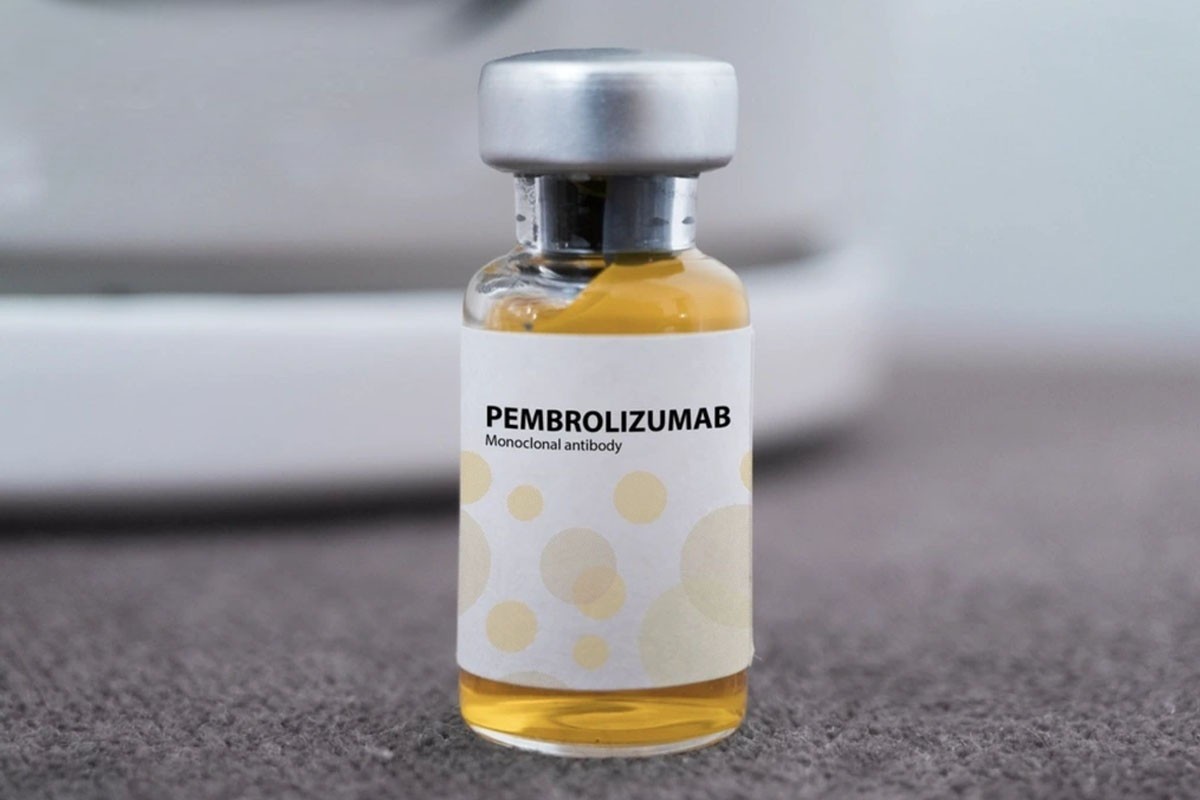
ยาเพมโบรเรียมีตัวยาสำคัญคือ Pembrolizumab
ตามข้อมูลของสำนักงานคณะกรรมการยา หลังจากได้รับใบรับรองการจดทะเบียนจำหน่ายยาแล้ว บริษัทจะต้องอัปเดตความคืบหน้าของการวิจัยทางคลินิกเกี่ยวกับการติดตามผลการสร้างภูมิคุ้มกันระยะที่ 3 เป็นระยะทุก 3 เดือนนับจากวันที่ออกใบรับรองการจดทะเบียนจำหน่ายยา กรุณาส่งเอกสารเพื่อเปลี่ยนแปลงและอัปเดตข้อมูลการติดตามผลการสร้างภูมิคุ้มกันระยะที่ 3 เมื่อสิ้นสุดระยะเวลาการวิจัย
นอกจาก Pembroria แล้ว วัคซีนและผลิตภัณฑ์ทางชีวภาพที่ได้รับใบรับรองการลงทะเบียนจำหน่าย ได้แก่:
- เมทาไลส์: ส่วนประกอบสำคัญหลัก: เทเนคเตพลาส; หมายเลขทะเบียน: 400410440125
- Spevigo: ส่วนประกอบสำคัญ: Spesolimab; หมายเลขทะเบียน: 400410440225
- Remsima: ส่วนประกอบสำคัญ: Infliximab; หมายเลขทะเบียน: 400410440325
- Soliris: ส่วนประกอบสำคัญ: Eculizumab; หมายเลขทะเบียน: 539410440425
- ฟลูมิสต์: ส่วนประกอบสำคัญ: วัคซีนไข้หวัดใหญ่ชนิดเชื้อเป็น (ชนิดลดฤทธิ์) หมายเลขทะเบียน: 001310440525
- Saphnelo: ส่วนประกอบสำคัญหลัก: Anifrolumab; หมายเลขทะเบียน: 870410440625
- Darzalex SC: สารออกฤทธิ์: ดาราทูมูแมบ; เลขทะเบียน: 760410440725
- Ruxience: ส่วนประกอบสำคัญ: Rituximab; หมายเลขทะเบียน: 540410440825
- Forsteo: ส่วนประกอบสำคัญหลัก: Teriparatide; หมายเลขทะเบียน: 300410440925
- Ocrevus: ส่วนประกอบสำคัญ: Ocrelizumab; หมายเลขทะเบียน: 400410441025
- Bemfola: ส่วนประกอบสำคัญหลัก: RHFSH (follitropin alfa); หมายเลขทะเบียน: 500410441125
- Ziextenzo: ส่วนประกอบสำคัญหลัก: Pegfilgrastim; หมายเลขทะเบียน: 900410441225
- Repatha: ส่วนประกอบสำคัญ: Evolocumab; หมายเลขทะเบียน: 001410441325
สำนักงานคณะกรรมการยา (อย.) กำหนดให้ทุกหน่วยงานรับผิดชอบยาทุกชนิดที่ผลิตและจัดส่งไปยังเวียดนามให้เป็นไปตามบันทึกและเอกสารที่จดทะเบียนกับกระทรวง สาธารณสุข ผลิตภัณฑ์แต่ละชนิดต้องมีหมายเลขทะเบียนที่ออกโดยกระทรวงสาธารณสุขพิมพ์หรือติดไว้บนฉลากยา เพื่อให้มั่นใจถึงความโปร่งใสและสามารถตรวจสอบย้อนกลับได้
สถานประกอบการเหล่านี้ต้องปฏิบัติตามกฎหมายและข้อบังคับของกระทรวงสาธารณสุขเวียดนามเกี่ยวกับการผลิต การนำเข้า และการจำหน่ายยาอย่างเคร่งครัด หากมีการเปลี่ยนแปลงใดๆ เกี่ยวกับยาในระหว่างการจำหน่ายในประเทศต้นทางหรือในเวียดนาม สถานประกอบการจะต้องรายงานให้สำนักงานคณะกรรมการยา กระทรวงสาธารณสุขทราบทันที
สำหรับสถานประกอบการที่ขึ้นทะเบียนยา จำเป็นต้องปฏิบัติตามหลักเกณฑ์วิธีการที่ดีในการผลิต (GMP) ของสถานประกอบการที่ผลิตยาและวัตถุดิบ ในกรณีที่สถานประกอบการถูกเพิกถอนใบอนุญาตหรือไม่เป็นไปตามมาตรฐาน GMP ในประเทศต้นทาง สถานประกอบการที่ขึ้นทะเบียนยาต้องรายงานต่อกระทรวงสาธารณสุขภายใน 15 วันนับจากวันที่ได้รับแจ้งอย่างเป็นทางการ ตามที่กำหนดไว้ในมาตรา 98 แห่งพระราชกฤษฎีกา 163/2025/ND-CP
นอกจากนี้ สถานประกอบการผลิตและขึ้นทะเบียนยาต้องประสานงานกับสถานพยาบาลและสถานพยาบาลป้องกันเพื่อบังคับใช้กฎระเบียบเกี่ยวกับยาที่ต้องสั่งโดยแพทย์อย่างครบถ้วน ตรวจสอบความปลอดภัย ประสิทธิภาพ และผลข้างเคียงที่ไม่พึงประสงค์ต่อประชาชนชาวเวียดนาม
ที่มา: https://baolaocai.vn/thuoc-chong-ung-thu-cua-nga-duoc-dang-ky-cap-phep-tai-viet-nam-post886566.html




![[ภาพ] นายกรัฐมนตรี Pham Minh Chinh ให้การต้อนรับนาย Phosay Sayasone รัฐมนตรีว่าการกระทรวงแรงงานและสวัสดิการของลาว](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)






































































































![การเปลี่ยนผ่าน OCOP ของจังหวัดด่งนาย: [มาตรา 3] การเชื่อมโยงการท่องเที่ยวกับการบริโภคผลิตภัณฑ์ OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








การแสดงความคิดเห็น (0)