ล่าสุดข่าวที่ว่า กระทรวงสาธารณสุข ได้อนุมัติใบรับรองการขึ้นทะเบียนจำหน่ายยารักษาโรคมะเร็งชื่อ Pembroria ที่ตีพิมพ์โดย หนังสือพิมพ์ Dan Tri ในเวียดนาม ได้รับความสนใจจากประชาชนเป็นพิเศษ
โดยเฉพาะอย่างยิ่ง ตามคำสั่งเลขที่ 628/QD-QLD ลงวันที่ 31 ตุลาคม ที่ออกโดยสำนักงานคณะกรรมการยาแห่งเวียดนาม กระทรวง สาธารณสุข ยา Pembroria ได้รับใบรับรองการลงทะเบียนจำหน่ายในเวียดนามโดยมีอายุ 3 ปี
ยา Pembroria มีตัวยาสำคัญหลักคือ Pembrolizumab ปริมาณ 100 มก./4 มล. ผลิตโดยบริษัทจำกัด "PK-137" (รัสเซีย) เตรียมในรูปแบบสารละลายเข้มข้นสำหรับการแช่ โดยมีอายุการเก็บรักษา 24 เดือนนับจากวันที่ผลิต

ยา Pembroria มีส่วนประกอบสำคัญคือ Pembrolizumab (ภาพ: incentra)
นอกเหนือจากรูปแบบข้างต้น ตามข้อมูลจากสถานที่ลงทะเบียนหมุนเวียน Pembroria ยังถูกเตรียมในรูปแบบสารละลายใสถึงทึบแสงเล็กน้อย ไม่มีสีถึงน้ำตาลอ่อนอีกด้วย
Pembroria ใช้สำหรับมะเร็งชนิดใด?
ตามคำแนะนำในการใช้จากหน่วยงานจดทะเบียน Pembroria มีข้อบ่งใช้สำหรับมะเร็งหลายประเภท
มะเร็งเหล่านี้ได้แก่ มะเร็งผิวหนังชนิดเมลาโนมา มะเร็งปอดชนิดไม่ใช่เซลล์เล็ก มะเร็งเซลล์สความัสของศีรษะและคอ มะเร็งต่อมน้ำเหลืองฮอดจ์กินแบบคลาสสิก มะเร็งเยื่อบุผิวทางเดินปัสสาวะ มะเร็งหลอดอาหาร มะเร็งลำไส้ใหญ่และทวารหนัก มะเร็งที่ไม่ใช่ลำไส้ใหญ่และทวารหนัก มะเร็งปากมดลูกและเยื่อบุโพรงมดลูก มะเร็งเซลล์ไต มะเร็งเต้านมชนิดสามชนิด มะเร็งต่อมน้ำเหลืองของกระเพาะอาหารหรือบริเวณรอยต่อหลอดอาหาร และมะเร็งท่อน้ำดี
Pembroria จะถูกกำหนดให้ใช้ตามช่วงอายุต่างๆ ขึ้นอยู่กับประเภทของมะเร็งและระยะของโรค (ระยะเริ่มต้นหรือระยะแพร่กระจาย) โดยใช้เป็นยาเดี่ยวหรือร่วมกับเคมีบำบัดและยาอื่นๆ
ยานี้ใช้ทั้งในผู้ป่วยนอกและในโรงพยาบาล การรักษาต้องเริ่มต้นและอยู่ภายใต้การดูแลของแพทย์ผู้เชี่ยวชาญด้านมะเร็งวิทยา
ในการที่จะสั่งจ่ายยาดังกล่าวข้างต้น ผู้ป่วยจะต้องทำการทดสอบ PD-L1 (การทดสอบทางอิมมูโนฮิสโตเคมีเพื่อวัดปริมาณโปรตีน PD-L1 บนพื้นผิวของเซลล์มะเร็ง) การทดสอบเพื่อตรวจสอบสถานะของเนื้องอกของความไม่เสถียรของไมโครแซทเทลไลต์ (MSI) หรือการขาดการซ่อมแซมที่ไม่ตรงกัน (MMR)
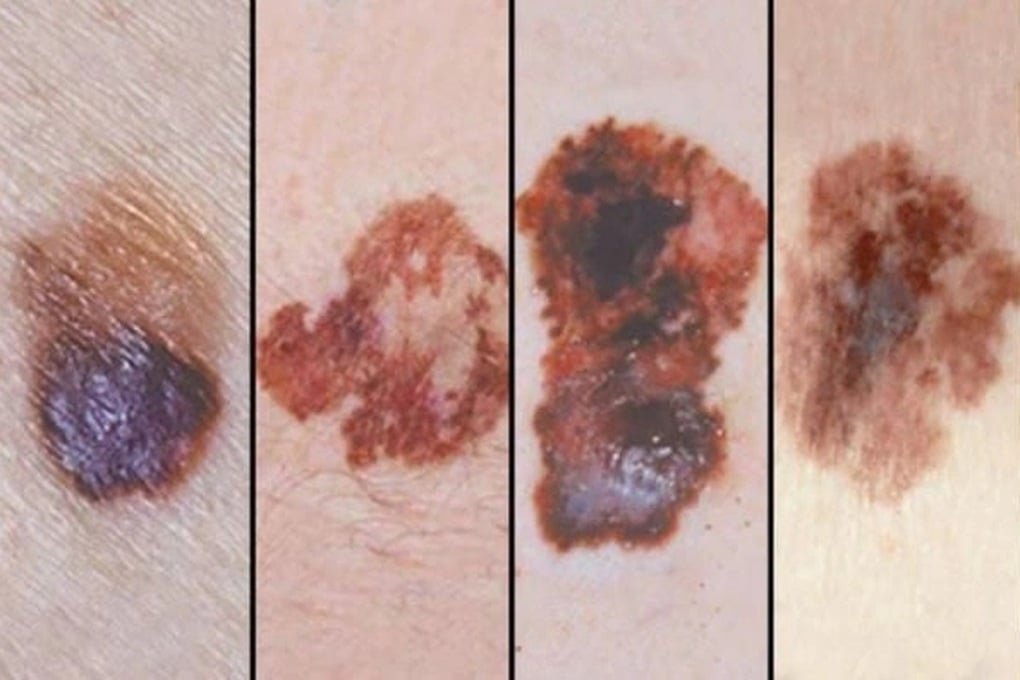
มะเร็งผิวหนังชนิดเมลาโนมาเป็นหนึ่งในโรคที่สามารถรักษาได้ด้วย Pembrolizumab (ภาพ: BV)
หมายเหตุในการใช้งาน
สำหรับขนาดยา ขนาดยาที่แนะนำของ Pembrolizumab ในผู้ใหญ่คือ 200 มก. ทุก 3 สัปดาห์ หรือ 400 มก. ทุก 6 สัปดาห์ โดยให้ทางเส้นเลือดดำ
ขนาดยา Pembrolizumab ที่แนะนำสำหรับการรักษาแบบเดี่ยวในผู้ป่วยเด็กอายุ 3 ปีขึ้นไป (ที่เป็นมะเร็งต่อมน้ำเหลืองฮอดจ์กินแบบคลาสสิก) หรือผู้ป่วยที่มีอายุ 12 ปีขึ้นไป (ที่เป็นมะเร็งผิวหนังเมลาโนมา) คือ 2 มก./กก. น้ำหนักตัว (สูงสุด 200 มก.) โดยให้ทางเส้นเลือดดำทุกๆ 3 สัปดาห์
ส่วนการใช้ร่วมกันจะขึ้นอยู่กับคุณสมบัติของผลิตภัณฑ์และการบำบัดร่วมด้วย
ขึ้นอยู่กับประเภทของมะเร็ง ผู้ป่วยจะได้รับคำแนะนำให้รับการรักษาด้วย Pembrolizumab จนกว่าจะมีหลักฐานของการลุกลามของโรคหรือความเป็นพิษที่ยอมรับไม่ได้

ผู้ป่วยโรคมะเร็งที่กำลังรับการรักษาที่โรงพยาบาล Cho Ray (ภาพ: Hoang Le)
ในการรักษาเสริมสำหรับมะเร็งบางชนิด (เช่น มะเร็งผิวหนัง มะเร็งปอดชนิดไม่ใช่เซลล์เล็ก หรือมะเร็งเซลล์ไต) ผู้ผลิตแนะนำให้ใช้เพมโบรลิซูแมบจนกว่าโรคจะกลับมาเป็นซ้ำ มีพิษในระดับที่ยอมรับไม่ได้ หรือนานถึง 1 ปี...
นอกจากข้อบ่งชี้ในการรักษาแล้ว ผู้ป่วยยังต้องใส่ใจต่อปฏิกิริยาที่เกี่ยวข้องกับภูมิคุ้มกันที่ไม่พึงประสงค์เมื่อใช้ Pembroria เพื่อปรับการใช้ยาให้เหมาะสม หยุดใช้ชั่วคราว หรือหยุดใช้อย่างไม่มีกำหนด
โดยเฉพาะอย่างยิ่งผู้ป่วยอาจประสบกับอาการต่างๆ เช่น ปอดบวม (เกรด 2-3) ลำไส้ใหญ่บวม (เกรด 2-3) โรคไตอักเสบ โรคต่อมไร้ท่อ โรคตับอักเสบ อาการแสดงใต้ผิวหนังรุนแรง...
หากผู้ป่วยเกิดภาวะกล้ามเนื้อหัวใจอักเสบ สมองอักเสบ กลุ่มอาการกิลแลง-บาร์เร (โรคเส้นประสาทอักเสบเฉียบพลัน) หรือมีปฏิกิริยารุนแรงหลังการฉีดยา (เกรด 3-4) จะต้องหยุดการรักษาด้วยยานี้อย่างถาวร
นอกจากนี้ ยังไม่มีการพิสูจน์ความปลอดภัยและประสิทธิภาพของเพมโบรลิซูแมบในผู้ที่มีอายุต่ำกว่า 18 ปี (ยกเว้นในผู้ป่วยเด็กที่เป็นมะเร็งเมลาโนมาและมะเร็งต่อมน้ำเหลืองฮอดจ์กินแบบคลาสสิก) นอกจากนี้ ขอแนะนำให้ให้ยาทางหลอดเลือดดำนานกว่า 30 นาที ไม่ควรฉีดเข้าหลอดเลือดดำแบบเร่งด่วนหรือฉีดเข้าหลอดเลือดดำแบบโบลัส
การให้สิทธิจดทะเบียนหมุนเวียนเพื่อดำเนินการวิจัยทางคลินิก
ในมาตรา 5 ข้อ 2 (เกี่ยวกับความรับผิดชอบของโรงงานผลิตและสถานที่ขึ้นทะเบียนยา) ของคำสั่งที่ 628/QD-QLD ที่ออกเมื่อวันที่ 31 ตุลาคม สำนักงานคณะกรรมการยาแห่งเวียดนาม กระทรวงสาธารณสุข ระบุว่า สำหรับยาหมายเลข 1 ในภาคผนวกของคำสั่งนี้ (Pembroria) หลังจากได้รับใบรับรองการขึ้นทะเบียนจำหน่ายแล้ว บริษัทจะต้องอัปเดตความคืบหน้าของการดำเนินการวิจัยทางคลินิกเป็นระยะๆ ตรวจสอบภูมิคุ้มกันในระยะที่ 3 และส่งเอกสารเพื่อเปลี่ยนแปลง เพิ่มเติม และอัปเดตข้อมูลการติดตามภูมิคุ้มกันในระยะที่ 3 เมื่อระยะเวลาการวิจัยสิ้นสุดลง
ข้อมูลจากสำนักงานคณะกรรมการอาหารและยาระบุว่า Pembroria เป็นแอนติบอดีโมโนโคลนอล ซึ่งผลิตขึ้นจากผลิตภัณฑ์ชีวภาพอ้างอิงดั้งเดิมของบริษัทยา MSD (สหรัฐอเมริกา) ตั้งแต่ปี พ.ศ. 2560 Keytruda ซึ่งเป็นยาอีกชนิดหนึ่งที่มีส่วนประกอบสำคัญคือ Pembrolizumab ได้รับอนุญาตให้จำหน่ายในเวียดนาม
ที่มา: https://dantri.com.vn/suc-khoe/thuoc-pembroria-cua-nga-duoc-chi-dinh-cho-cac-loai-ung-thu-gi-20251111231728560.htm


![[ภาพ] นายกรัฐมนตรี Pham Minh Chinh ให้การต้อนรับนาย Phosay Sayasone รัฐมนตรีว่าการกระทรวงแรงงานและสวัสดิการของลาว](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)






























































































![การเปลี่ยนผ่าน OCOP ของจังหวัดด่งนาย: [มาตรา 3] การเชื่อมโยงการท่องเที่ยวกับการบริโภคผลิตภัณฑ์ OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








การแสดงความคิดเห็น (0)