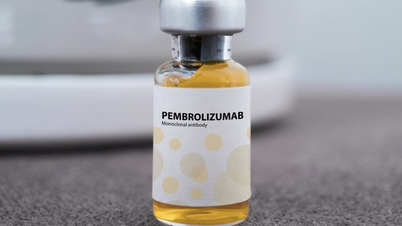
Управління з лікарських засобів В'єтнаму ( Міністерство охорони здоров'я ) видало свідоцтво про реєстрацію обігу у В'єтнамі на препарат Pembroria, що виробляється в Росії, що має понад 14 показань для лікування різних видів раку.
У якому Пемброрія (основна діюча речовина – пембролізумаб, вміст 100 мг/4 мл) виробляється Товариством з обмеженою відповідальністю «ПК-137» (Росія). Реєстраційне підприємство: Anabion Pharmaceutical Trading Ltd, Об’єднані Арабські Емірати. Пемброрія випускається у формі концентрованого розчину для інфузій, термін придатності – 24 місяці з дати виробництва. Упаковка: 1 флакон х 4 мл.
Активний інгредієнт пембролізумаб має понад 14 показань для лікування різних видів раку (таких як рак легенів, меланома, колоректальний рак, рак шийки матки, нирково-клітинна карцинома, рак молочної залози...).
У рішенні 628/QD-QLD чітко зазначено, що установи з виробництва та реєстрації ліків несуть відповідальність за: виробництво та постачання ліків до В'єтнаму відповідно до записів та документів, зареєстрованих у Міністерстві охорони здоров'я .
Заклад реєстрації лікарських засобів повинен звітувати Міністерству охорони здоров'я про дотримання належної виробничої практики на підприємстві з виробництва лікарських засобів та лікарських інгредієнтів. У разі анулювання ліцензії на виробництво у виробничого підприємства або недотримання ним належної виробничої практики лікарських засобів та лікарських інгредієнтів у країні походження, підприємство повинно скласти звіт протягом 15 днів з дати повідомлення компетентним органом управління країни походження.
Водночас, координувати дії з лікувальними та профілактичними медичними закладами щодо дотримання чинних правил щодо рецептурних препаратів, контролювати безпеку, ефективність та небажані наслідки для в'єтнамців, а також синтезувати та звітувати відповідно до правил.
Управління з лікарських засобів В'єтнаму вимагає, щоб після отримання сертифіката про реєстрацію обігу лікарського засобу компанія періодично оновлювала інформацію про хід клінічних досліджень щодо моніторингу імуногенності фази III кожні 3 місяці з дати видачі сертифіката про реєстрацію обігу лікарського засобу та подавав документи для зміни та оновлення даних моніторингу імуногенності фази III після закінчення періоду дослідження.
Джерело: https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html






![[Фото] Прем'єр-міністр Фам Мінь Чінь приймає міністра праці та соціального забезпечення Лаосу Пхосая Саясоне](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)






![[Відео] Багато об'єктів занепали, оскільки дві великі лікарні повільно вводять в експлуатацію](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762906839099_dung00-29-15-18still010-jpg.webp)




![[Відео] Чу Нят Куанг – від «Священного знаку» до світового рекорду](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762909239247_2385424671828914264-8140-jpg.webp)

![[Відео] Проекти документів 14-го Національного конгресу підкреслюють ключову роль зовнішньої політики](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/12/1762905940110_dung00-24-48-14still009-jpg.webp)



































































![Перехідний період Донг Най OCOP: [Стаття 3] Зв'язок туризму зі споживанням продукції OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








Коментар (0)