Нещодавно особливу увагу громадськості отримала новина про те, що Міністерство охорони здоров'я видало свідоцтво про реєстрацію обігу у В'єтнамі на протипухлинний препарат під назвою Pembroria, опублікована газетою Dan Tri .
Зокрема, згідно з рішенням № 628/QD-QLD від 31 жовтня, виданим Управлінням з контролю за лікарськими засобами В'єтнаму Міністерства охорони здоров'я , препарату Pembroria видано свідоцтво про реєстрацію обігу у В'єтнамі терміном дії 3 роки.
Препарат «Пемброрія» має основним діючим інгредієнтом пембролізумаб, вміст 100 мг/4 мл, виробництва Товариства з обмеженою відповідальністю «ПК-137» (Росія), приготований у формі концентрованого розчину для інфузій, термін придатності якого становить 24 місяці з дати виробництва.

Ліки від пемброрії мають основний діючий інгредієнт пембролізумаб (Фото: incentra).
Окрім вищезазначеної форми, згідно з інформацією з пункту реєстрації обігу, препарат Пемброрія також готується у вигляді прозорого або злегка непрозорого, безбарвного або світло-коричневого розчину.
При яких типах раку показана пемброрія?
Згідно з інструкцією із застосування від реєстраційного агентства, препарат Пемброрія показаний при багатьох видах раку.
Це меланома; недрібноклітинний рак легень; плоскоклітинний рак голови та шиї; класична лімфома Ходжкіна; уротеліальний рак; рак стравоходу; колоректальний рак; неколоректальний рак; рак шийки матки та ендометрію; нирково-клітинна карцинома; потрійно-негативний рак молочної залози; аденокарцинома шлунка або гастроезофагеального переходу; та холангіокарцинома.
Залежно від типу раку та стадії захворювання (ранньої чи метастатичної), Пемброрію призначатимуть у різному віці, використовуватимуть як монотерапію або в поєднанні з хіміотерапією та іншими препаратами.
Цей препарат застосовується як в амбулаторних, так і в лікарняних умовах. Лікування має бути розпочате та під наглядом досвідчених онкологів.
Щоб отримати вищезазначений препарат, пацієнтам необхідно пройти тестування PD-L1 (імуногістохімічне тестування для вимірювання кількості білка PD-L1 на поверхні ракових клітин), тестування для визначення статусу пухлини, пов'язаного з нестабільністю мікросателітів (MSI) або дефіцитом репарації неспарених нуклеотидів (MMR).
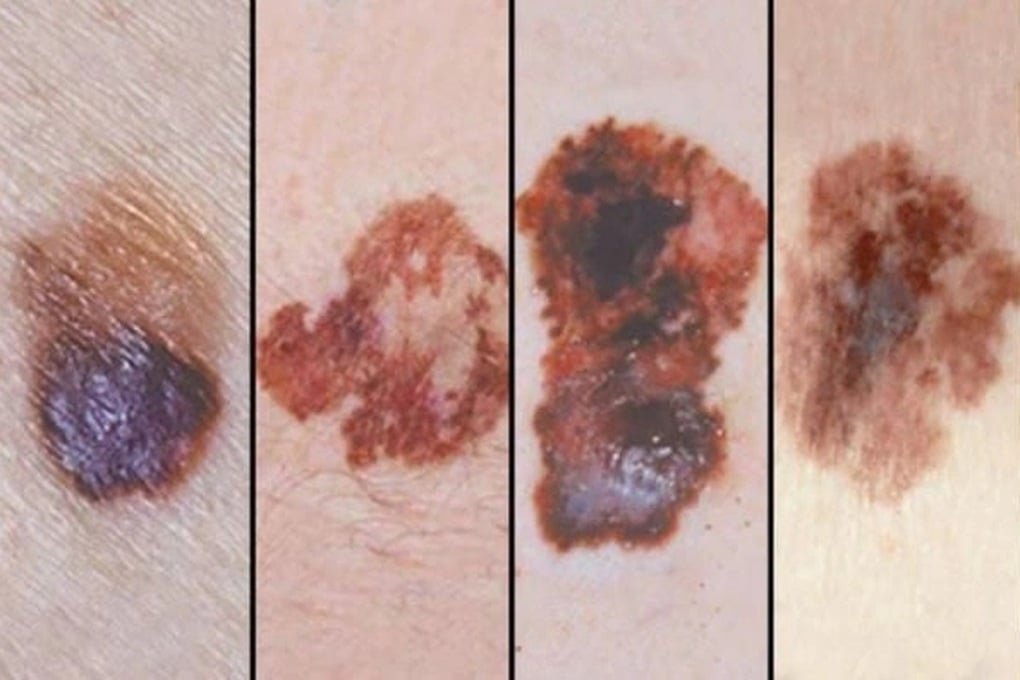
Злоякісна меланома – одне із захворювань, яке можна лікувати пембролізумабом (Фото: BV).
Примітки щодо використання
Щодо дозування, рекомендована доза пембролізумабу для дорослих становить 200 мг кожні 3 тижні або 400 мг кожні 6 тижнів у вигляді внутрішньовенної інфузії.
Рекомендована доза пембролізумабу як монотерапії для дітей віком від 3 років (з класичною лімфомою Ходжкіна) або віком від 12 років (з меланомою) становить 2 мг/кг маси тіла (максимум 200 мг), що вводиться у вигляді внутрішньовенної інфузії кожні 3 тижні.
Щодо комбінованого застосування, це залежатиме від властивостей продукту та супутньої терапії.
Залежно від типу раку, пацієнтам рекомендується отримувати лікування пембролізумабом, доки не з'являться ознаки прогресування захворювання або неприйнятної токсичності.

Пацієнти з онкологічними захворюваннями отримують лікування в лікарні Чо Рай (Фото: Хоанг Ле).
При ад'ювантному лікуванні деяких видів раку (таких як меланома, недрібноклітинна карцинома легень або нирково-клітинна карцинома) виробник рекомендує застосовувати пембролізумаб до рецидиву захворювання, неприйнятної токсичності або до 1 року…
Окрім показань до лікування, пацієнтам також необхідно звертати увагу на побічні імуноасоційовані реакції під час використання препарату Пемброрія, щоб внести відповідні корективи, тимчасово припинити використання або припинити його на невизначений термін.
Зокрема, у пацієнтів можуть виникнути такі захворювання, як пневмонія (2-3 ступеня), коліт (2-3 ступеня), нефрит, ендокринні захворювання, гепатит, тяжкі підшкірні реакції...
Якщо у пацієнта розвивається міокардит, енцефаліт, синдром Гійєна-Барре (гостра полінейропатія) або тяжкі постін'єкційні реакції (3-4 ступеня), лікування цим препаратом необхідно остаточно припинити.
Крім того, безпека та ефективність пембролізумабу для осіб віком до 18 років не встановлені (за винятком дітей з меланомою та класичною лімфомою Ходжкіна). Також рекомендується вводити препарат внутрішньовенно протягом 30 хвилин, а не шляхом швидкої внутрішньовенної ін'єкції або внутрішньовенної болюсної ін'єкції.
Надання реєстрації обігу для проведення клінічних досліджень
У Розділі 5 статті 2 (щодо обов'язків виробничого підприємства та установи реєстрації лікарських засобів) Рішення № 628/QD-QLD, виданого 31 жовтня, Управління з лікарських засобів В'єтнаму Міністерства охорони здоров'я зазначило, що для препарату № 1 у Додатку до цього Рішення (Pembroria) після отримання сертифіката про реєстрацію в обігу компанія повинна періодично оновлювати інформацію про хід проведення клінічних досліджень, контролювати імуногенність фази III та подавати документи для зміни, доповнення та оновлення даних моніторингу імуногенності фази III після завершення періоду дослідження.
Згідно з інформацією Управління з контролю за лікарськими засобами, Pembroria – це моноклональне антитіло, вироблене на основі оригінального референтного біологічного продукту фармацевтичної компанії MSD (США). З 2017 року у В'єтнамі ліцензовано для обігу Keytruda – ще один препарат з основним активним інгредієнтом пембролізумаб.
Джерело: https://dantri.com.vn/suc-khoe/thuoc-pembroria-cua-nga-duoc-chi-dinh-cho-cac-loai-ung-thu-gi-20251111231728560.htm



![[Фото] Прем'єр-міністр Фам Мінь Чінь взяв участь у конференції, присвяченій підсумкам року розгортання сил для участі у забезпеченні безпеки та порядку на низовому рівні.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762957553775_dsc-2379-jpg.webp)



![[Фото] Автомагістралі, що проходять через Донг Най](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/12/1762940149627_ndo_br_1-resize-5756-jpg.webp)



























































































![Перехідний період Донг Най OCOP: [Стаття 3] Зв'язок туризму зі споживанням продукції OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Коментар (0)