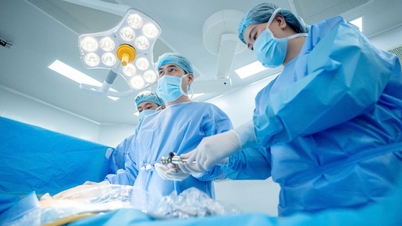
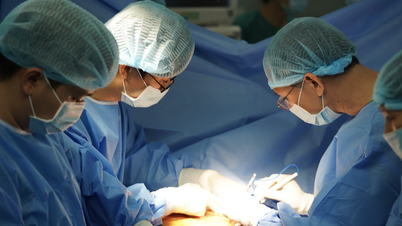
ویتنام کی ڈرگ ایڈمنسٹریشن ( وزارت صحت ) نے ویتنام میں دوا پیمبروریا کے لیے سرکولیشن رجسٹریشن سرٹیفکیٹ دیا ہے جس میں روس میں پیدا ہونے والے کینسر کی مختلف اقسام کے لیے 14 سے زیادہ اشارے ہیں۔
جس میں پیمبروریا (اہم فعال جزو پیمبرولیزوماب ہے، مواد 100mg/4ml) محدود ذمہ داری کمپنی "PK-137" (روس) نے تیار کیا ہے۔ رجسٹریشن کی سہولت: انابیون فارماسیوٹیکل ٹریڈنگ لمیٹڈ، متحدہ عرب امارات۔ پیمبروریا کو انفیوژن کے لیے مرتکز محلول کی شکل میں تیار کیا جاتا ہے، جس کی شیلف لائف تیاری کی تاریخ سے 24 ماہ ہوتی ہے۔ پیکیجنگ: 1 بوتل x 4ml۔
فعال جزو Pembrolizumab کینسر کی مختلف اقسام کے لیے 14 سے زیادہ اشارے رکھتا ہے (جیسے پھیپھڑوں کا کارسنوما، میلانوما، کولوریکٹل کینسر، سروائیکل کینسر، رینل سیل کارسنوما، چھاتی کا کینسر...)۔
فیصلہ 628/QD-QLD واضح طور پر کہتا ہے کہ منشیات کی تیاری اور رجسٹریشن کے ادارے ذمہ دار ہیں: وزارت صحت کے ساتھ رجسٹرڈ ریکارڈ اور دستاویزات کے مطابق ویتنام کو ادویات تیار کرنا اور سپلائی کرنا۔
منشیات کے اندراج کی سہولت کو منشیات اور منشیات کے اجزاء کی تیاری کی سہولت کے اچھے مینوفیکچرنگ طریقوں کی تعمیل کی دیکھ بھال پر وزارت صحت کو رپورٹ کرنا ہوگی۔ اگر مینوفیکچرنگ سہولت کا مینوفیکچرنگ لائسنس منسوخ کر دیا جاتا ہے یا وہ اپنے ملک میں منشیات اور منشیات کے اجزاء کے اچھے مینوفیکچرنگ طریقوں کی تعمیل کرنے میں ناکام رہتا ہے، تو اس سہولت کو اپنے ملک کی مجاز انتظامی ایجنسی کی طرف سے اطلاع کی تاریخ سے 15 دنوں کے اندر رپورٹ دینی چاہیے۔
ایک ہی وقت میں، علاج کی سہولیات اور احتیاطی طبی سہولیات کے ساتھ ہم آہنگی پیدا کریں تاکہ نسخے کی دوائیوں کے موجودہ ضوابط کی تعمیل کی جا سکے، ویتنامی لوگوں پر دوائیوں کی حفاظت، تاثیر، اور ناپسندیدہ اثرات کی نگرانی کریں، اور ضوابط کے مطابق ترکیب کریں اور رپورٹ کریں۔
ویتنام کی ڈرگ ایڈمنسٹریشن کا تقاضہ ہے کہ، ڈرگ سرکولیشن رجسٹریشن سرٹیفکیٹ دیے جانے کے بعد، کمپنی کو منشیات کی گردش کے رجسٹریشن سرٹیفکیٹ کے اجرا کی تاریخ سے ہر 3 ماہ بعد فیز III امیونوجنیسیٹی مانیٹرنگ پر کلینیکل ریسرچ کی پیشرفت کو اپ ڈیٹ کرنا چاہیے اور فیز III امیونوجنیسیٹی مانیٹرنگ ڈیٹا کو تبدیل کرنے اور اپ ڈیٹ کرنے کے لیے دستاویزات جمع کرانا چاہیے۔
ماخذ: https://nhandan.vn/thuoc-chong-ung-thu-cua-nga-duoc-cap-phep-luu-hanh-tai-viet-nam-post922311.html


![[تصویر] وزیر اعظم فام من چن نے لاؤ کے وزیر محنت اور بہبود فوسے سیاسون کا استقبال کیا](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)























































































![ڈونگ نائی OCOP منتقلی: [آرٹیکل 3] سیاحت کو OCOP مصنوعات کی کھپت سے جوڑنا](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








تبصرہ (0)