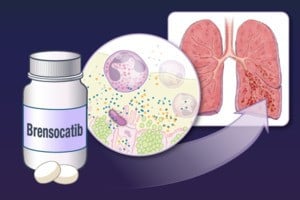
ការសម្រេចចិត្តនេះត្រូវបានគេមើលឃើញថាជាជំហានឆ្ពោះទៅមុខដ៏សំខាន់មួយក្នុងការថែទាំសុខភាពផ្លូវដង្ហើម ដោយសារបច្ចុប្បន្នមិនមានការព្យាបាលដែលត្រូវបានអនុម័តសម្រាប់ការប្រើប្រាស់ដោយផ្ទាល់ប្រឆាំងនឹងជំងឺនោះទេ។
NCFB គឺជាជំងឺរ៉ាំរ៉ៃដែលបំផ្លាញផ្លូវដង្ហើម និងកាត់បន្ថយមុខងារសួតបន្តិចម្តងៗ ដែលនាំឱ្យមានការក្អកជាប់រហូត ដង្ហើមខ្លី និងស្ទះលំហូរខ្យល់។ ជារឿយៗវាបណ្តាលមកពីការរលាក និងការឆ្លងម្តងហើយម្តងទៀត ដែលអាចត្រូវបានបង្កឡើងដោយមូលហេតុផ្សេងៗគ្នា រួមទាំងការឆ្លងមេរោគផ្លូវដង្ហើម ជំងឺអូតូអ៊ុយមីន ឬជំងឺប្រព័ន្ធភាពស៊ាំ។ នៅក្នុងសហភាពអឺរ៉ុប ចំនួនមនុស្សដែលមាន NCFB ត្រូវបានប៉ាន់ប្រមាណថាមានចាប់ពី 400,000 ទៅ 3 លាននាក់ ដែលបង្ហាញពីតម្រូវការបន្ទាន់សម្រាប់ការព្យាបាលប្រកបដោយសុវត្ថិភាព និងប្រសិទ្ធភាព។
ការអនុញ្ញាតទីផ្សារនៃ brensocatib គឺផ្អែកលើការពិនិត្យ បែបវិទ្យាសាស្ត្រ វិជ្ជមានដោយទីភ្នាក់ងារឱសថអឺរ៉ុប (EMA) ដែលបង្ហាញពីប្រសិទ្ធភាពនៃថ្នាំក្នុងការពន្យឺតការវិវត្តនៃជំងឺ និងការគ្រប់គ្រងរោគសញ្ញាធ្ងន់ធ្ងរ។ Brensocatib គឺជាថ្នាំតាមវេជ្ជបញ្ជា គួរតែត្រូវបានប្រើក្រោមការណែនាំរបស់វេជ្ជបណ្ឌិត ហើយអាចបណ្តាលឱ្យមានផលប៉ះពាល់មួយចំនួន ដែលត្រូវបានរាយបញ្ជីយ៉ាងពេញលេញនៅក្នុងព័ត៌មានផលិតផល។ ថ្នាំនេះមិនត្រូវបានណែនាំសម្រាប់ប្រើចំពោះស្ត្រីមានផ្ទៃពោះទេ ហើយគួរតែត្រូវបានចេញវេជ្ជបញ្ជាដោយប្រុងប្រយ័ត្នក្នុងក្រុមអ្នកជំងឺពិសេស។
Brensocatib ដំណើរការដោយការកែប្រែការឆ្លើយតបរលាកនៅក្នុងផ្លូវដង្ហើម ដោយកាត់បន្ថយហានិភ័យនៃការឆ្លងមេរោគម្តងទៀត។ ការអនុម័តរបស់ EC មិនត្រឹមតែដោះស្រាយតម្រូវការ ផ្នែកវេជ្ជសាស្រ្ដ ដែលមិនបានទទួលអស់រយៈពេលជាច្រើនឆ្នាំប៉ុណ្ណោះទេ ប៉ុន្តែថែមទាំងបើកលទ្ធភាពនៃការកែលម្អគុណភាពជីវិតរយៈពេលវែងសម្រាប់អ្នកជំងឺដែលមានជំងឺ NCFB ដោយជួយពួកគេឱ្យគ្រប់គ្រងរោគសញ្ញា និងរក្សាសកម្មភាពប្រចាំថ្ងៃរបស់ពួកគេ។
ប្រភព៖ https://nhandan.vn/eu-cap-phep-thuoc-moi-dieu-tri-benh-phoi-man-tinh-nghiem-trong-post924109.html


![[រូបថត] អគ្គលេខាធិកា To Lam ទទួលជួបឧបនាយករដ្ឋមន្ត្រី និងជារដ្ឋមន្ត្រីក្រសួងការពារជាតិស្លូវ៉ាគី លោក Robert Kalinak](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/18/1763467091441_a1-bnd-8261-6981-jpg.webp)
![[រូបថត] នាយករដ្ឋមន្ត្រី Pham Minh Chinh និងភរិយាជួបសហគមន៍វៀតណាមនៅអាល់ហ្សេរី](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/19/1763510299099_1763510015166-jpg.webp)
































































































Kommentar (0)