Hälsoministeriet (Läkemedelsverket) har skickat ett dokument till hälsovårdsmyndigheterna i provinser och centralt administrerade städer samt till läkemedelstillverkningsanläggningar angående stärkande av efterlevnaden av GMP och inspektion och övervakning av produktionsaktiviteter vid läkemedelstillverkningsanläggningar enligt följande:
För läkemedelstillverkningsanläggningar måste råvarorna strikt följa principerna och standarderna för "Good Manufacturing Practice" (GMP) som föreskrivits av hälsoministeriet genom hela läkemedelsproduktionsprocessen, såväl som vid produktion av hälsotillskott (om det är tillåtet att produceras på samma produktionslinje som läkemedel).
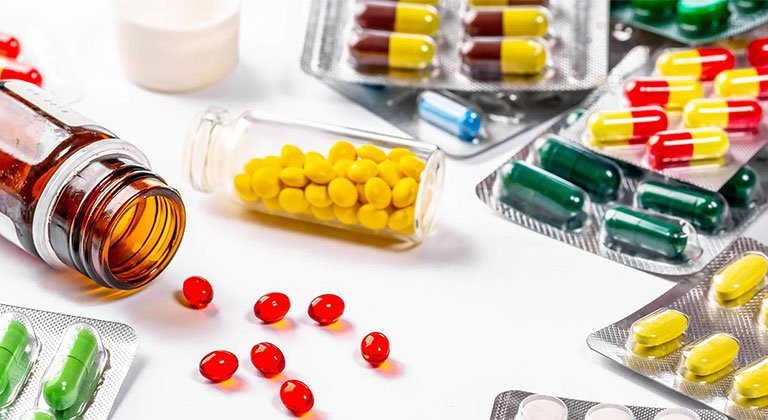
Strikt kontroll över ursprung, kvalitet och användning av farmaceutiska råvaror är avgörande för att säkerställa att material som används i produktionen är avsedda för det avsedda ändamålet, kommer från rätt tillverkare enligt läkemedelsregistreringsunderlaget och levereras från råvaruproduktions- och distributionsanläggningar som har genomgått en grundlig leverantörsutvärdering.
Råvaror för läkemedel måste genomgå kvalitetskontroller och uppfylla de kvalitetsstandarder som godkänts av hälsoministeriet i läkemedelsregistreringsunderlaget innan de används i läkemedelsproduktion.
Granska produktionsprocessen, produktionsregister och testregister för att säkerställa att produktionsprocessen och kvalitetskontrollprocedurerna följs enligt specificeringen i det godkända och validerade läkemedelsregistreringsunderlaget, och för att fullt ut följa alla föreskrifter gällande läkemedelsregistrering.
Läkemedelsverket anger tydligt att vid ändringar i produktionsprocessen, kvalitetsstandarder eller analytiska procedurer för att säkerställa metodens genomförbarhet, noggrannhet och precision, måste ändringsprocedurerna genomföras omedelbart i enlighet med föreskrifterna om läkemedelsregistrering, och kan endast genomföras efter att ha granskats och godkänts av hälsoministeriet (läkemedelsverket) enligt föreskrifter.
Upprätta ett omfattande kvalitetsledningssystem som kontrollerar aktiviteter i enlighet med GMP-, GLP- och GSP-standarder; följa alla lagstadgade bestämmelser för produktion och verksamhet med läkemedel och hälsotillskott (om sådana finns).
Stärka egeninspektion och granskning av efterlevnaden av GMP, GLP, GSP och lagar under produktion och affärsverksamhet, snabbt upptäcka och korrigera fel och hållas ansvarig inför lag och tillsynsmyndigheter för kvaliteten och säkerheten hos de produkter som tillverkas av anläggningen, inklusive läkemedel och hälsokostprodukter.
Rapportera omedelbart till hälsoministeriet och den lokala hälsomyndigheten när problem som rör kvaliteten och säkerheten hos produkter som tillverkas av anläggningen upptäcks.
För hälsovårdsmyndigheterna i provinser och centralt administrerade städer ber Vietnams läkemedelsmyndighet dem att stärka inspektionen och tillsynen av läkemedelstillverkningsanläggningar i sina områden, särskilt de som producerar hälsokosttillskott och kosmetika.
Proaktivt samla in information och kontrollera efterlevnaden av föreskrifter gällande produktion, råvaruanvändning, märkning, reklam etc., och upprätthålla GMP- och GSP-principer i produktions- och lagringsaktiviteter.
Hantera eventuella överträdelser strikt i enlighet med lagen om de upptäcks och rapportera dem till hälsoministeriet (Department of Drug Administration, Department of Traditional Medicine Management, Department of Food Safety) för snabba åtgärder.
Källa: https://baolaocai.vn/bo-y-te-kiem-soat-chat-nguon-goc-chat-luong-va-viec-su-dung-nguyen-lieu-lam-thuoc-post402764.html



![[Foto] Premiärminister Pham Minh Chinh leder konferensen där man tillkännager inrättandet av Internationella finanscentret i Vietnam.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F21%2F1766309817714_ndo_br_dsc-3400-jpg.webp&w=3840&q=75)


![[Foto] Premiärminister Pham Minh Chinh leder ett möte om den privata sektorns ekonomiska utveckling.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F20%2F1766237501876_thiet-ke-chua-co-ten-40-png.webp&w=3840&q=75)



























































































Kommentar (0)