أرسلت وزارة الصحة (إدارة الأدوية) وثيقة إلى إدارات الصحة في المحافظات والمدن الخاضعة للإدارة المركزية؛ وإلى مرافق تصنيع الأدوية بشأن تعزيز الامتثال لممارسات التصنيع الجيدة (GMP) وتفتيش ومراقبة أنشطة الإنتاج في مرافق تصنيع الأدوية على النحو التالي:
بالنسبة لمرافق تصنيع الأدوية، يجب أن تضمن المواد الخام الامتثال الصارم لمبادئ ومعايير "ممارسات التصنيع الجيدة" (GMP) كما هو منصوص عليه من قبل وزارة الصحة طوال عملية إنتاج الأدوية بأكملها، وكذلك إنتاج المكملات الغذائية (إذا كان مسموحًا بإنتاجها على نفس خط إنتاج الأدوية).
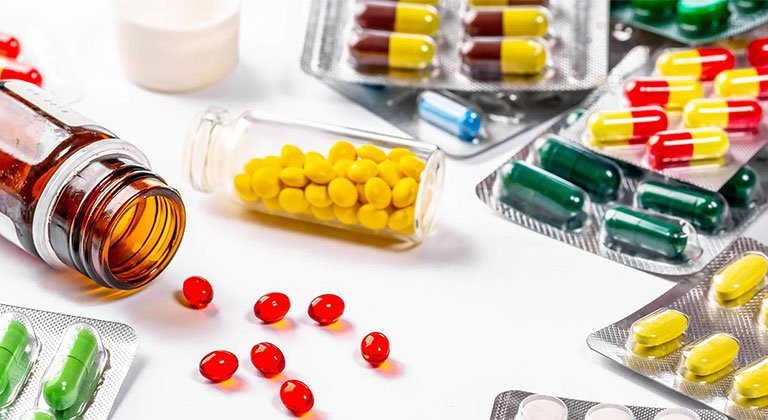
إن الرقابة الصارمة على أصل وجودة واستخدام المواد الخام الصيدلانية أمر ضروري لضمان أن المواد المستخدمة في الإنتاج هي للغرض المقصود، وأنها تأتي من الشركة المصنعة الصحيحة كما هو مذكور في ملف تسجيل الدواء، وأنها يتم توريدها من مرافق إنتاج وتوزيع المواد الخام التي خضعت لتقييم شامل للموردين.
يجب أن تخضع المواد الخام المستخدمة في صناعة الأدوية لفحوصات الجودة وأن تستوفي معايير الجودة المعتمدة من قبل وزارة الصحة في ملف تسجيل الدواء قبل استخدامها في إنتاج الأدوية.
مراجعة عملية الإنتاج وسجلات الإنتاج وسجلات الاختبار لضمان الامتثال لعملية الإنتاج وإجراءات مراقبة الجودة كما هو محدد في ملف تسجيل الأدوية المعتمد والمصدق عليه، والامتثال الكامل لجميع اللوائح المتعلقة بتسجيل الأدوية.
تنص إدارة إدارة الأدوية بوضوح على أنه في حالات حدوث تغييرات في عملية الإنتاج أو معايير الجودة أو الإجراءات التحليلية لضمان جدوى ودقة ووضوح الطريقة، يجب تنفيذ إجراءات التغيير على الفور وفقًا للوائح تسجيل الأدوية، ولا يمكن تنفيذها إلا بعد مراجعتها واعتمادها من قبل وزارة الصحة (إدارة إدارة الأدوية) على النحو المنصوص عليه.
إنشاء نظام شامل لإدارة الجودة، والتحكم في الأنشطة وفقًا لمعايير GMP و GLP و GSP؛ والامتثال الكامل لجميع اللوائح القانونية في إنتاج وتجارة الأدوية والمكملات الصحية (إن وجدت).
تعزيز التفتيش الذاتي ومراجعة الامتثال لممارسات التصنيع الجيدة (GMP) وممارسات المختبرات الجيدة (GLP) وممارسات التخزين الجيدة (GSP) واللوائح القانونية أثناء عمليات الإنتاج والأعمال، والكشف عن الأخطاء وتصحيحها على الفور، والمساءلة أمام القانون والهيئات التنظيمية عن جودة وسلامة المنتجات المصنعة من قبل المنشأة، بما في ذلك المستحضرات الصيدلانية ومنتجات الأغذية الصحية.
يجب الإبلاغ فوراً إلى وزارة الصحة وإدارة الصحة المحلية عند اكتشاف أي مشاكل تتعلق بجودة وسلامة المنتجات المصنعة من قبل المنشأة.
تطلب إدارة الأدوية في فيتنام من إدارات الصحة في المحافظات والمدن التي تدار مركزياً تعزيز عمليات التفتيش والإشراف على مرافق تصنيع الأدوية في مناطقها، وخاصة تلك التي تنتج المكملات الغذائية ومستحضرات التجميل.
جمع المعلومات بشكل استباقي والتحقق من الامتثال للوائح المتعلقة بالإنتاج واستخدام المواد الخام ووضع العلامات والإعلان وما إلى ذلك، والحفاظ على مبادئ GMP و GSP في أنشطة الإنتاج والتخزين.
يجب التعامل بصرامة مع أي انتهاكات وفقًا للقانون في حالة اكتشافها، وإبلاغ وزارة الصحة (إدارة إدارة الأدوية، إدارة إدارة الطب التقليدي، إدارة سلامة الأغذية) لاتخاذ الإجراءات اللازمة في الوقت المناسب.
المصدر: https://baolaocai.vn/bo-y-te-kiem-soat-chat-nguon-goc-chat-luong-va-viec-su-dung-nguyen-lieu-lam-thuoc-post402764.html




![[صورة] رئيس الوزراء فام مينه تشينه يترأس اجتماعاً حول التنمية الاقتصادية للقطاع الخاص.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F20%2F1766237501876_thiet-ke-chua-co-ten-40-png.webp&w=3840&q=75)


![[صورة] رئيس الوزراء فام مينه تشينه يترأس المؤتمر الذي أعلن فيه عن إنشاء المركز المالي الدولي في فيتنام.](/_next/image?url=https%3A%2F%2Fvphoto.vietnam.vn%2Fthumb%2F1200x675%2Fvietnam%2Fresource%2FIMAGE%2F2025%2F12%2F21%2F1766309817714_ndo_br_dsc-3400-jpg.webp&w=3840&q=75)





























































































تعليق (0)