Es necesario modificar y complementar la Ley de Farmacia.
La Ley de Farmacia de 2016 regula básicamente de manera integral las cuestiones relacionadas con el sector farmacéutico, relacionadas con las políticas del Estado sobre el desarrollo de la industria farmacéutica y de farmacias; la práctica farmacéutica; el negocio farmacéutico; el registro, circulación, retiro de medicamentos e ingredientes farmacéuticos; las hierbas medicinales y las medicinas tradicionales; las recetas y el uso de medicamentos; la información sobre medicamentos, la farmacovigilancia y la publicidad de medicamentos; la farmacia clínica; la gestión de medicamentos en las instalaciones de examen y tratamiento médico; los ensayos clínicos de medicamentos y los ensayos de bioequivalencia de medicamentos; la gestión de la calidad, seguridad, eficacia de los medicamentos, ingredientes farmacéuticos y la gestión de los precios de los medicamentos.
El Proyecto de Ley que modifica y complementa la Ley de Farmacia de 2016 es necesario para el desarrollo de la industria farmacéutica nacional. (Foto ilustrativa).
La Ley de Farmacia de 2016 ha contribuido a crear un entorno de inversión empresarial abierto e igualitario, creando la máxima comodidad para las empresas, básicamente garantizando un suministro adecuado de medicamentos de calidad a precios razonables, la industria farmacéutica nacional ha alcanzado el nivel 3.5/5 según la escala de clasificación de la Organización Mundial de la Salud (OMS).
Tras más de 7 años de implementación de la Ley de Farmacia de 2016, la industria farmacéutica ha alcanzado importantes logros. Sus disposiciones han sentado las bases legales para el desarrollo de la industria farmacéutica, con un enfoque en la apertura y la transparencia, demostrando progreso e integración con países de la región y del mundo en la regulación de los principios y estándares de Buenas Prácticas en las actividades farmacéuticas, desde la producción, la exportación, la importación, las pruebas, la venta al por mayor y la venta al por menor, garantizando así la calidad de los medicamentos que llegan a los consumidores, contribuyendo así a la protección y el cuidado de la salud de las personas.
Sin embargo, frente a los requisitos y demandas urgentes de la práctica, el sistema jurídico farmacéutico ha revelado una serie de limitaciones e insuficiencias inadecuadas relacionadas con el registro de medicamentos e ingredientes farmacéuticos, la gestión de la calidad, las políticas de desarrollo de la industria farmacéutica, la gestión de precios de medicamentos que no es adecuada a la práctica, así como las leyes de precios recientemente emitidas...
Según el Ministerio de Salud , para superar las limitaciones y deficiencias mencionadas, es necesario elaborar un proyecto de ley que modifique y complemente una serie de artículos de la Ley de Farmacia.
Novedades en el proyecto de Ley revisada y complementada de Farmacia
El proyecto de Ley que modifica y complementa una serie de artículos de la Ley de Farmacia incluye 3 artículos, en los que se modifican y complementan 44 artículos de 08 capítulos de un total de 116 artículos de 14 capítulos de la Ley de Farmacia de 2016, incluidos los siguientes 8 nuevos puntos:
En primer lugar, el proyecto de ley que modifica y complementa una serie de artículos de la Ley de Farmacia ha institucionalizado todos los mecanismos de políticas especiales y específicos que la Ley de Farmacia de 2016 no tiene regulaciones o las tiene pero no es adecuada, que han sido permitidos por la Asamblea Nacional, el Comité Permanente de la Asamblea Nacional y el Gobierno para manejar con prontitud los medicamentos y vacunas para la prevención y el tratamiento de enfermedades durante la reciente pandemia de Covid-19 para garantizar la viabilidad y la estabilidad en caso de una pandemia...
En segundo lugar , modificar y complementar una serie de reglamentos para promover el desarrollo de la industria farmacéutica, añadiendo políticas más apropiadas e innovadoras en comparación con la Ley de Farmacia de 2016 para atraer inversiones y promover aún más la investigación y el desarrollo de la producción de materia prima farmacéutica; la investigación, recibir transferencia de tecnología para la producción de medicamentos de alta tecnología, medicamentos biotecnológicos y especialidades de tratamiento especial, especialmente la investigación.
En tercer lugar, diversificar el sistema y los métodos de comercialización y distribución de medicamentos e ingredientes farmacéuticos de acuerdo con el desarrollo económico y social y aumentar el suministro de medicamentos a la población.
En cuarto lugar , simplificar los procedimientos para conceder certificados de registro de medicamentos, aumentando la posibilidad de que las personas accedan a los medicamentos de forma temprana y al mismo tiempo garantizando el control de calidad, la seguridad y la eficacia, así como el cumplimiento de las prácticas internacionales.
En quinto lugar, la autoridad para retirar medicamentos se delega al Departamento de Salud en el caso de retiro obligatorio de medicamentos que no cumplen con los estándares de calidad de nivel 2 o nivel 3 detectados en el área con el fin de manejar y retirar rápidamente los medicamentos que violan la calidad en el área de gestión, garantizando un uso seguro y efectivo de los medicamentos y de conformidad con las regulaciones sobre responsabilidades y poderes de las agencias de inspección de calidad de productos y bienes, incluidas las agencias de inspección de calidad de productos y bienes bajo los Comités Populares de provincias y ciudades en la Ley de Calidad de Productos y Bienes.
En sexto lugar, se busca ampliar el reconocimiento, la aceptación y la aplicación de los principios y normas de Buenas Prácticas de Fabricación de medicamentos e ingredientes farmacéuticos de países de todo el mundo como base para evaluar el cumplimiento de las condiciones de las instalaciones de fabricación de medicamentos e ingredientes farmacéuticos en el extranjero, a fin de garantizar el suministro de materias primas para las plantas de fabricación de medicamentos vietnamitas y evitar interrupciones en el suministro de medicamentos para el tratamiento.
En séptimo lugar, se deben simplificar los procedimientos administrativos, reducir algunas condiciones empresariales de acuerdo con las políticas y directrices del Partido y del Estado para crear condiciones favorables, aumentar la proactividad de las empresas y fortalecer la inspección y supervisión de la implementación por parte de los organismos de gestión estatal.
El octavo es fortalecer la gestión estricta de los precios de los medicamentos para estabilizar el mercado de medicamentos de acuerdo con las disposiciones de la Ley de Precios de 2023 y debe garantizar la especificidad del producto farmacéutico, que es un artículo en el que las personas no tienen opción, a través de la gestión de los precios declarados de los medicamentos y los precios mayoristas esperados de los medicamentos para minimizar el nivel intermedio que se ha gestionado de manera efectiva de acuerdo con las disposiciones de la Ley de Farmacia.
Con los nuevos puntos mencionados anteriormente en el proyecto de ley que modifica y complementa una serie de artículos de la Ley de Farmacia sobre la base de 5 políticas aprobadas por la Asamblea Nacional, se espera que las deficiencias e insuficiencias existentes en la gestión estatal de los productos farmacéuticos se resuelvan de manera fundamental, ayudando a la industria farmacéutica a seguir desarrollándose fuertemente, así como a garantizar el suministro oportuno de medicamentos de calidad, seguros, eficaces y a precios razonables para las personas en el futuro.
La Ley de Farmacia fue aprobada por la 13ª Asamblea Nacional el 6 de abril de 2016, reemplazando la Ley de Farmacia de 2005, marcando un paso importante en el perfeccionamiento del sistema legal sobre farmacia en Vietnam, básicamente en línea con el desarrollo de la industria farmacéutica en la tendencia de integración internacional.
[anuncio_2]
Fuente: https://www.baogiaothong.vn/8-diem-moi-trong-du-thao-luat-duoc-sua-doi-va-bo-sung-192240615100926803.htm




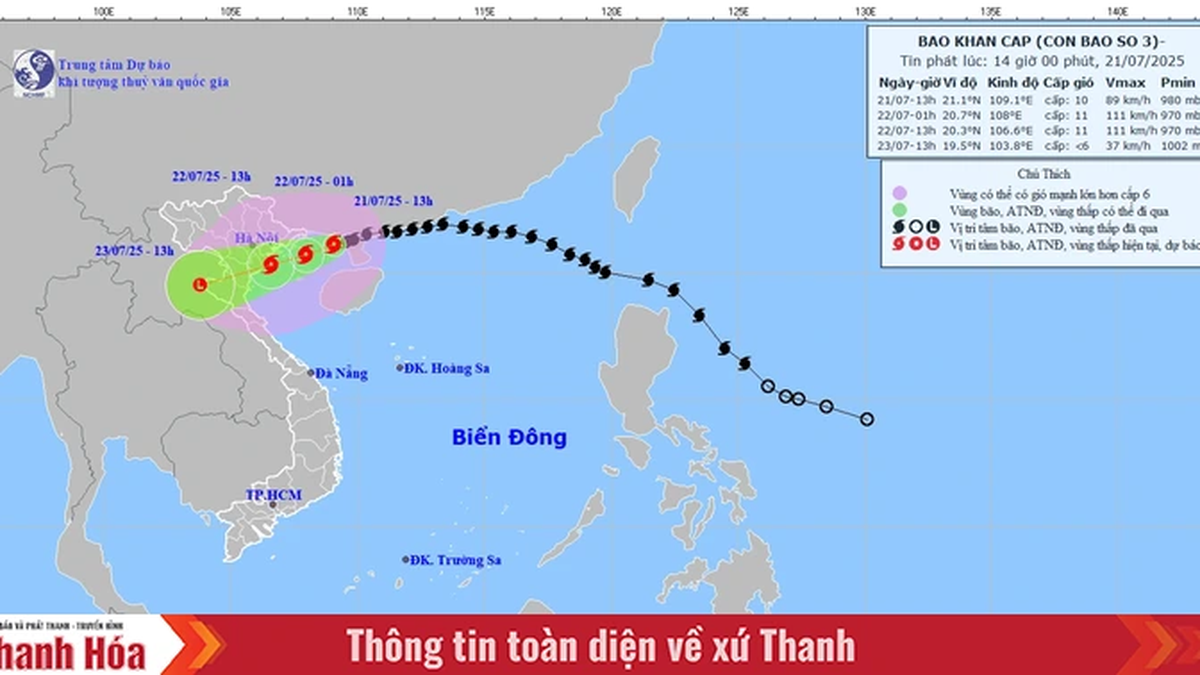

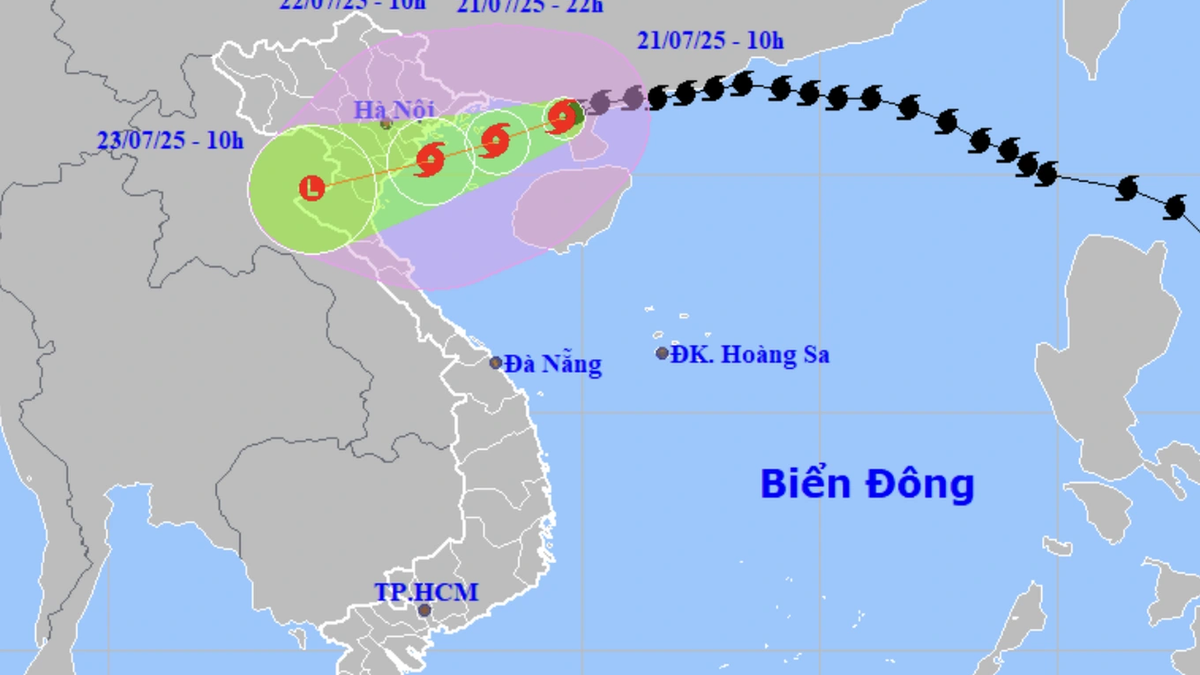


















![[Foto] El presidente de la Asamblea Nacional, Tran Thanh Man, visita a la heroica madre vietnamita Ta Thi Tran](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/7/20/765c0bd057dd44ad83ab89fe0255b783)










































































Kommentar (0)