ວັນທີ 11 ພະຈິກນີ້, ກະຊວງສາທາລະນະສຸກ ຫວຽດນາມ ໄດ້ປະກາດມະຕິສະບັບເລກທີ 628/QD-QLD ລົງວັນທີ 31/10 ກ່ຽວກັບຢາວັກຊີນ 14 ຊະນິດ ແລະ ຊີວະພາບ 14 ຊະນິດທີ່ໄດ້ຮັບການຈົດທະບຽນຈຳໜ່າຍຢູ່ຫວຽດນາມ.
ໃນບັນດາພວກມັນ, ມີຢາ Pembroria (ສ່ວນປະກອບຫຼັກແມ່ນ Pembrolizumab, ເນື້ອໃນ 100mg/4ml) ຜະລິດໂດຍບໍລິສັດຮັບຜິດຊອບຈໍາກັດ "PK-137" (ລັດເຊຍ), ລົງທະບຽນໂດຍສະຖານທີ່ໃນສະຫະລັດອາຫລັບເອມິເຣດ.
ຢາ Pembroria ໄດ້ຖືກກະກຽມໃນຮູບແບບຂອງການແກ້ໄຂເຂັ້ມຂຸ້ນສໍາລັບການ້ໍາຕົ້ມ, ມີອາຍຸການເກັບຮັກສາຂອງ 24 ເດືອນນັບຈາກວັນທີ່ຜະລິດ.
ປະຈຸບັນ Pembrolizumab ມີຫຼາຍກວ່າ 14 ຕົວຊີ້ບອກຂອງມະເຮັງປະເພດຕ່າງໆ (ເຊັ່ນ: ມະເຮັງປອດ, ມະເຮັງເຕົ້ານົມ, ມະເຮັງລຳໄສ້ໃຫຍ່, ມະເຮັງປາກມົດລູກ, ມະເຮັງເຊລມະເຮັງຕັບ, ມະເຮັງເຕົ້ານົມ...)
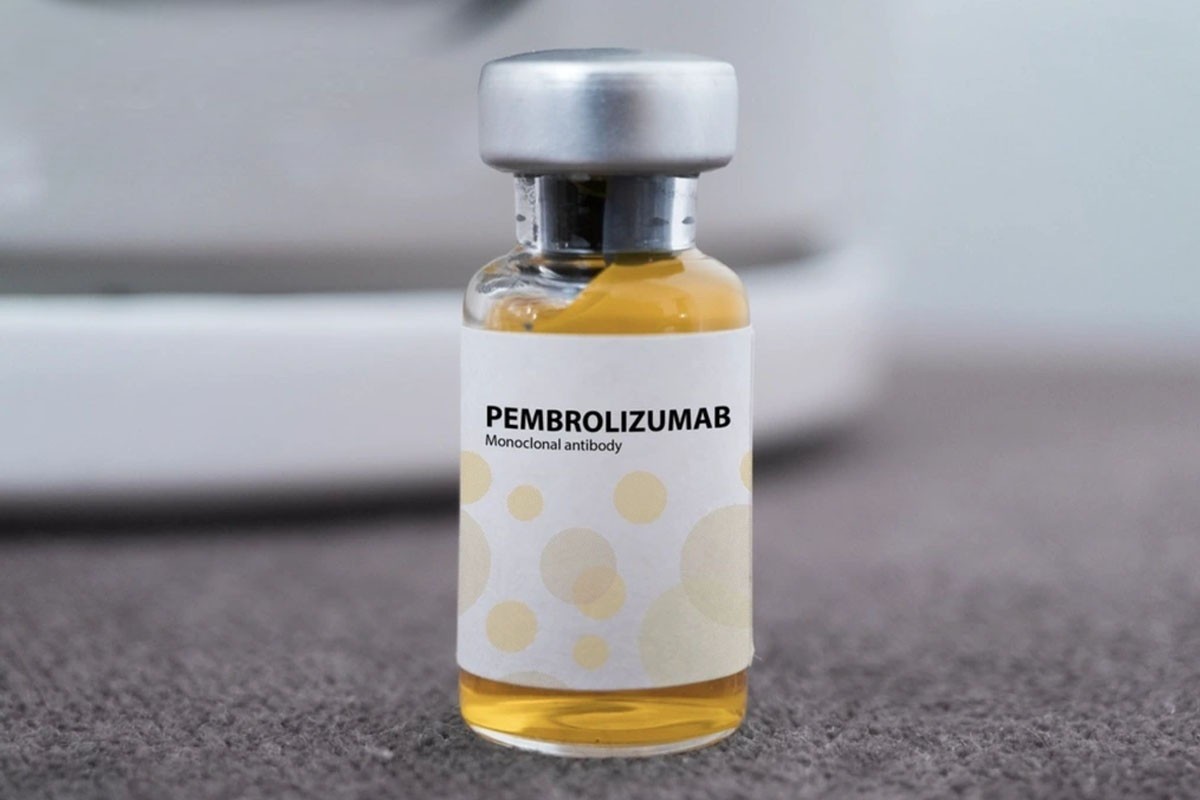
ຢາ Pembroria ມີສ່ວນປະກອບຫຼັກຂອງ Pembrolizumab.
ອີງຕາມອົງການຢາ, ຫຼັງຈາກໄດ້ຮັບໃບຢັ້ງຢືນການຈົດທະບຽນການໄຫຼວຽນ, ບໍລິສັດຕ້ອງໄດ້ປັບປຸງຄວາມຄືບຫນ້າຂອງການຄົ້ນຄວ້າທາງດ້ານການຊ່ວຍໃນການຕິດຕາມໄລຍະ III immunogenicity ທຸກໆ 3 ເດືອນນັບຈາກວັນອອກໃບຢັ້ງຢືນການໄຫຼວຽນຂອງ. ສົ່ງເອກະສານເພື່ອປ່ຽນແປງແລະປັບປຸງຂໍ້ມູນກ່ຽວກັບການຕິດຕາມໄລຍະ III immunogenicity ເມື່ອໄລຍະເວລາການຄົ້ນຄວ້າສິ້ນສຸດລົງ.
ນອກເຫນືອໄປຈາກ Pembroria, ວັກຊີນແລະຜະລິດຕະພັນຊີວະພາບທີ່ໄດ້ຮັບໃບຢັ້ງຢືນການລົງທະບຽນການໄຫຼວຽນຂອງປະກອບມີ:
- Metalyse: ສ່ວນປະກອບຫຼັກ: Tenecteplase; ໝາຍເລກທະບຽນ: 400410440125
- Spesvigo: ສ່ວນປະກອບທີ່ໃຊ້ໄດ້: Spesolimab; ໝາຍເລກທະບຽນ: 400410440225
- Remsima: ສ່ວນປະກອບ: Infliximab; ໝາຍເລກທະບຽນ: 400410440325
- Soliris: ສ່ວນປະກອບ: Eculizumab; ໝາຍເລກທະບຽນ: 539410440425
- Flumist: ສ່ວນປະກອບທີ່ໃຊ້ໄດ້: ວັກຊີນໄຂ້ຫວັດໃຫຍ່ທີ່ມີຊີວິດ (Atenuated); ໝາຍເລກທະບຽນ: 001310440525
- Saphnelo: ສ່ວນປະກອບຫຼັກ: Anifrolumab; ໝາຍເລກທະບຽນ: 870410440625
- Darzalex SC: ສ່ວນປະກອບທີ່ໃຊ້ໄດ້: Daratumumab; ໝາຍເລກທະບຽນ: 760410440725
- Ruxience: ສ່ວນປະກອບ: Rituximab; ໝາຍເລກທະບຽນ: 540410440825
- Forsteo: ສ່ວນປະກອບຫຼັກ: Teriparatide; ໝາຍເລກທະບຽນ: 300410440925
- Ocrevus: ສ່ວນປະກອບ: Ocrelizumab; ໝາຍເລກທະບຽນ: 400410441025
- Bemfola: ສ່ວນປະກອບຫຼັກ: RHFSH (follitropin alfa); ໝາຍເລກທະບຽນ: 500410441125
- Ziextenzo: ສ່ວນປະກອບຫຼັກ: Pegfilgrastim; ໝາຍເລກທະບຽນ: 900410441225
- Repatha: ສ່ວນປະກອບ: Evolocumab; ໝາຍເລກທະບຽນ: 001410441325
ອົງການຢາຮຽກຮ້ອງໃຫ້ທຸກໜ່ວຍງານຮັບຜິດຊອບຕໍ່ຢາທັງໝົດທີ່ຜະລິດ ແລະ ສະໜອງໃຫ້ຫວຽດນາມ ເພື່ອປະຕິບັດຕາມບັນທຶກ ແລະ ເອກະສານທີ່ຂຶ້ນທະບຽນກັບກະຊວງ ສາທາລະນະສຸກ . ແຕ່ລະຜະລິດຕະພັນຕ້ອງມີເລກທະບຽນຂອງກະຊວງສາທາລະນະສຸກພິມອອກ ຫຼື ຕິດໃສ່ປ້າຍຢາເພື່ອຮັບປະກັນຄວາມໂປ່ງໃສ ແລະ ການກວດສອບ.
ສິ່ງອໍານວຍຄວາມສະດວກເຫຼົ່ານີ້ຕ້ອງປະຕິບັດຢ່າງຄົບຖ້ວນຕາມກົດໝາຍ ແລະ ລະບຽບການຂອງກະຊວງສາທາລະນະສຸກຫວຽດນາມ ກ່ຽວກັບການຜະລິດ, ການນຳເຂົ້າ ແລະ ຈຳໜ່າຍຢາ. ຖ້າມີການປ່ຽນແປງໃດໆກ່ຽວກັບຢາໃນໄລຍະການແຜ່ກະຈາຍຢູ່ໃນປະເທດບ້ານເກີດຫຼືໃນປະເທດຫວຽດນາມ, ສະຖານທີ່ຕ້ອງໄດ້ຮັບການລາຍງານຕໍ່ອົງການຢາຂອງກະຊວງສາທາລະນະສຸກໂດຍທັນທີ.
ສໍາລັບການຈົດທະບຽນຢາ, ການຮັກສາການປະຕິບັດການຜະລິດທີ່ດີ (GMP) ຂອງໂຮງງານຜະລິດຢາແລະວັດຖຸດິບແມ່ນບັງຄັບ. ກໍລະນີໂຮງງານຜະລິດຖືກຖອນໃບອະນຸຍາດ ຫຼື ບໍ່ໄດ້ມາດຕະຖານ GMP ໃນປະເທດບ້ານເກີດ, ການຈັດຕັ້ງຂຶ້ນທະບຽນຢາຕ້ອງລາຍງານໃຫ້ກະຊວງສາທາລະນະສຸກພາຍໃນ 15 ວັນ ນັບແຕ່ມື້ໄດ້ຮັບແຈ້ງການຢ່າງເປັນທາງການ, ຕາມທີ່ໄດ້ກຳນົດໄວ້ໃນມາດຕາ 98 ຂອງດຳລັດ 163/2025/ນຍ-ກປ.
ນອກຈາກນັ້ນ, ໂຮງງານຜະລິດ ແລະຂຶ້ນທະບຽນຢາຕ້ອງສົມທົບກັບບັນດາສະຖານທີ່ປິ່ນປົວ, ໂຮງໝໍປ້ອງກັນ, ປະຕິບັດບັນດາລະບຽບການກ່ຽວກັບຢາຕາມໃບສັ່ງຂອງ, ຕິດຕາມກວດກາຄວາມປອດໄພ, ປະສິດທິຜົນ, ຜົນກະທົບທີ່ບໍ່ຕ້ອງການຂອງຊາວຫວຽດນາມ.
ທີ່ມາ: https://baolaocai.vn/thuoc-chong-ung-thu-cua-nga-duoc-dang-ky-cap-phep-tai-viet-nam-post886566.html



![[ຮູບຖ່າຍ] ທ່ານນາຍົກລັດຖະມົນຕີ ຟ້າມມີງຈິ້ງ ໃຫ້ການຕ້ອນຮັບທ່ານ ໂພໄຊ ໄຊຍະສອນ ລັດຖະມົນຕີກະຊວງແຮງງານ ແລະສະຫວັດດີການສັງຄົມ.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762872028311_dsc-2246-jpg.webp)

![[ຮູບພາບ] Chu Noodles - ໂດຍເນື້ອແທ້ແລ້ວຂອງເຂົ້າແລະແສງແດດ](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/11/1762846220477_ndo_tl_7-jpg.webp)



























































































![ການຫັນປ່ຽນ OCOP ດົງນາຍ: [ມາດຕາ 3] ເຊື່ອມໂຍງການທ່ອງທ່ຽວກັບການບໍລິໂພກຜະລິດຕະພັນ OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)








(0)