Potrivit profesorului Dr. Le Van Quang, directorul Spitalului K, unitatea va introduce în curând Medicamentul Pembroria în regimul de tratament pentru pacienții cu cancer. Medicamentul Pembroria (Rusia) este produs, costă aproximativ 18 milioane VND pe flacon, pacienții folosesc de obicei două flacoane într-o cură. Cura de tratament durează între 12 și 24 de cure sau până când pacientul nu mai răspunde la medicament. În prezent, medicamentul nu este acoperit de asigurarea de sănătate .
Potrivit reprezentantului Administrației Medicamentelor ( Ministerul Sănătății ), Pembroria a finalizat studiile clinice și a primit autorizația oficială de circulație în Vietnam. Medicamentul este produs de Biocad (Rusia), înregistrat de o companie cu sediul în Emiratele Arabe Unite. Licența permite importul, distribuirea și utilizarea pe scară largă a medicamentului și nu face parte din grupa medicamentelor speciale sau restricționate.
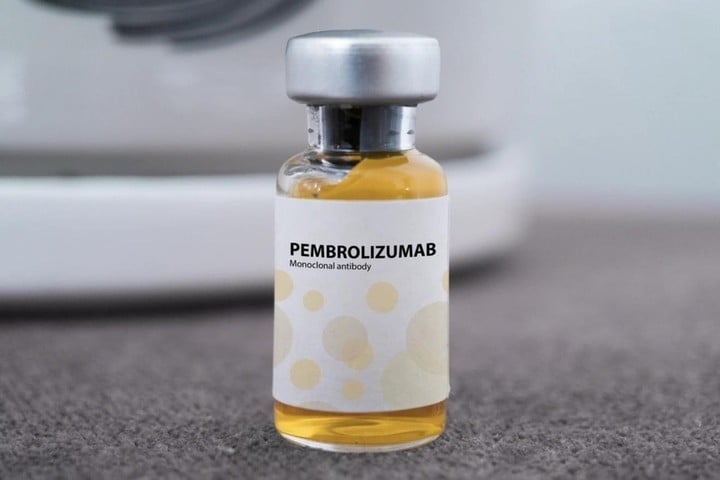
În esență, Pembroria este un „biosimilar” al Keytruda - produsul original dezvoltat de MSD (SUA), care conține și ingredientul activ Pembrolizumab. Acesta este un anticorp monoclonal care ajută sistemul imunitar să recunoască și să distrugă celulele canceroase și este considerat una dintre cele mai eficiente imunoterapii din prezent. Keytruda a fost aprobat de SUA în 2014 și autorizat pentru circulație în Vietnam în 2017.
Apariția Pembroriei este așteptată să deschidă un acces mai mare la tratament pentru pacienții cu cancer, când costul este semnificativ mai mic - aproximativ 18 milioane VND pe flacon, comparativ cu 55-65 de milioane VND pentru Keytruda. Cu toate acestea, ambele medicamente nu sunt încă acoperite de asigurarea de sănătate.
Pembrolizumab acționează prin „eliberare rapidă” în celulele imune T. În mod normal, celulele canceroase trimite un semnal de „oprire” care împiedică atacul celulelor T. Medicamentul va bloca acest semnal, reactivând capacitatea de a distruge tumorile, fiind eficient asupra multor tipuri de cancer, cum ar fi cel pulmonar, renal, de col uterin, melanom...
Conform Administrației Medicamentelor, întregul dosar de autorizare a circulației medicamentului a fost depus de companie în conformitate cu reglementările. Până în 2024, acest medicament finalizase studiile clinice. Cu toate acestea, compania a continuat să efectueze o evaluare a imunogenității - o cerință obligatorie pentru medicamentele biosimilare precum acest produs, nu un nou studiu clinic.
În timpul procesului de circulație, întreprinderile sunt responsabile pentru monitorizarea și raportarea periodică a siguranței, eficacității și imunogenității medicamentului după 3 sau 5 ani, conform cerințelor agenției de management.
Anterior, multe medicamente care conțineau ingredientul activ Pembrolizumab erau autorizate pentru circulație în țară. Decizia 628/QD-QLD din 31 octombrie a Administrației Medicamentelor a aprobat 14 vaccinuri și produse biologice, inclusiv Pembroria (100 mg/4 ml), soluție concentrată perfuzabilă, cu o dată de expirare de 24 de luni de la data fabricației.
Sursă: https://baolangson.vn/thuoc-ung-thu-pembroria-cua-nga-vua-duoc-cap-phep-tai-viet-nam-co-gia-bao-nhieu-5064810.html




![[Foto] Depozite de nisip din adâncurile mării, nava antică din lemn An Bang riscă să fie îngropată din nou](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1763033175715_ndo_br_thuyen-1-jpg.webp)

























































































![Tranziția Dong Nai OCOP: [Articolul 3] Legarea turismului cu consumul de produse OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Comentariu (0)