У г-жи Д. был рак лёгких в терминальной стадии с метастазами в головной мозг, кости и другие органы. Благодаря обнаружению генной мутации ей была назначена целевая терапия, которая помогла ей выйти из критического состояния и продлить жизнь.
У г-жи Д. был рак лёгких в терминальной стадии с метастазами в головной мозг, кости и другие органы. Благодаря обнаружению генной мутации ей была назначена целевая терапия, которая помогла ей выйти из критического состояния и продлить жизнь.
Реанимация пациентов с раком легких
В конце января 51-летний пациент CTND пришел на повторный прием к доктору Нго Туан Фуку, онкологу, после 10 месяцев лечения немелкоклеточного рака легких 4 стадии.
На данный момент г-жа Д. значительно поправилась: у нее больше нет невнятной речи, рот больше не искривлен, она нормально ест, набрала 10 кг и больше не чувствует себя полностью истощенной, что совершенно отличается от февраля 2024 года, когда г-жу Д. срочно доставили в отделение неотложной помощи в критическом состоянии.
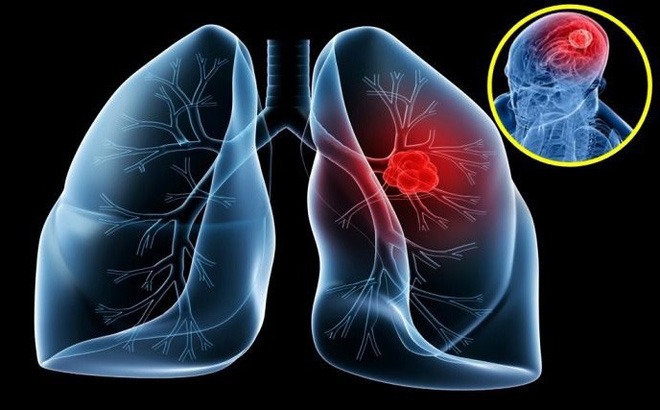 |
| Иллюстрация фото. |
Вспоминая момент госпитализации в феврале 2024 года, ее родственники сообщили, что у нее были трудности с речью, затуманенное зрение, отек левой руки и затрудненное дыхание, а также метастазы рака легких.
Результаты МРТ выявили множественные очаги поражения головного мозга, наиболее крупный из которых находился в левой лобной доле размером 32x31 мм, что привело к отёку мозга и сдавлению левого желудочка. Это и стало причиной неврологических осложнений у г-жи Д.
Доктор Фук сказал, что без своевременного лечения риск смерти г-жи Д. был бы очень высок. После консультации с онкологом-радиологом врач принял решение о лечении отёка мозга методами внутренней терапии и биопсии правого шейного лимфатического узла.
Результаты генетического исследования показали, что у г-жи Д. была мутация гена ALK — редкая мутация при немелкоклеточном раке лёгкого (составляющая 4,4–6,7%), часто выявляемая при метастазах в головной мозг. Для лечения г-же Д. были назначены таргетные препараты, блокирующие мутацию ALK и высокоэффективные в облегчении неврологических симптомов.
Всего через неделю лечения у г-жи Д. исчезли затрудненное дыхание, затуманенное зрение, отёк левой руки, а также значительно уменьшились такие симптомы, как искривление рта, невнятная речь и гемиплегия. Доктор Фук оценил выздоровление г-жи Д. как очень позитивное и продолжил назначать целенаправленные препараты в сочетании с физиотерапией для улучшения её состояния.
В настоящее время, после более чем 10 месяцев лечения, результаты КТ лёгких показывают, что опухоль в лёгких уменьшилась в размерах и практически не осталось следов. Однако опухоль головного мозга демонстрирует признаки рецидива, и г-же Д. может потребоваться лучевая терапия головного мозга или продолжение лечения таргетными препаратами нового поколения для предотвращения прогрессирования заболевания.
Что касается лечения, то в октябре 2023 года г-жа Д. прошла плановый осмотр и обнаружила левый плевральный выпот. КТ выявила опухоль лёгкого размером 3x3 см и большой объём левого плеврального выпота, вызвавший коллапс лёгкого. После бронхоскопии и биопсии был подтвержден рак лёгкого – аденокарцинома.
Ранее врачи прогнозировали, что г-же Д. осталось жить от 6 месяцев до года. Однако благодаря раннему выявлению генетических мутаций и правильному лечению её шансы на выживание и продление жизни значительно возросли.
По статистике Всемирной организации по борьбе с раком (Globocan), рак легких занимает второе место среди наиболее распространенных видов рака как у мужчин, так и у женщин во Вьетнаме.
Рак лёгких подразделяется на два основных типа: мелкоклеточный рак лёгких и немелкоклеточный рак лёгких. Немелкоклеточный рак лёгких составляет около 80% случаев рака лёгких, как и в случае г-жи Д.
Доктор Фук объяснил, что рак возникает в результате изменений в генах, контролирующих рост клеток. Эти мутации часто вызываются факторами окружающей среды, такими как химические вещества, ультрафиолетовое излучение, бактерии или ошибки в процессе репликации ДНК клетки. Открытие мутаций генов при немелкоклеточном раке лёгких позволило разработать новый метод лечения, который «блокирует» мутации и предотвращает рост опухоли.
Таргетная терапия открывает новую эру в лечении распространенного немелкоклеточного рака легких, помогая продлить выживаемость и улучшить качество жизни пациентов.
Однако препарат дорогой, что затрудняет его доступность для многих пациентов. Однако с развитием современной медицины врачи рассчитывают обнаружить больше генных мутаций и предложить эффективные методы лечения, одновременно снижая стоимость препаратов и расширяя возможности лечения для пациентов.
Девочка с расширенными камерами сердца из-за осложнений дефекта межпредсердной перегородки
Операция для 11-месячного Трюка была сложной, поскольку ребенок имел недостаточный вес, большой дефект межпредсердной перегородки, а также существовал риск повреждения сердечного клапана, если бы зонтик оказался слишком большим.
По словам врачей, дефект межпредсердной перегородки (ДМПП) — это врождённый порок сердца, характеризующийся образованием отверстия между двумя предсердиями (верхними камерами сердца). Небольшой дефект межпредсердной перегородки (менее 5 мм) может закрыться самостоятельно.
Более крупные отверстия, протекающие бессимптомно и не вызывающие проблем со здоровьем, не требуют хирургического вмешательства в раннем возрасте, но требуют наблюдения и могут потребовать вмешательства в более старшем возрасте. В случаях возникновения осложнений, таких как расширение правых отделов сердца, замедление набора веса или сердечная недостаточность, необходимо своевременное вмешательство.
Малышка Трук родилась доношенной, весом почти 3,8 кг. Её мать рассказала, что в её семье никто не страдал сердечно-сосудистыми заболеваниями, и во время беременности никаких отклонений не было обнаружено. Когда ребёнку исполнилось два месяца, она пошла на вакцинацию и общий осмотр, где услышала шум в сердце.
Этот звук возникает из-за неравномерного кровотока в сердце или около него, что указывает на некоторые сердечно-сосудистые заболевания. Семья отвела ребёнка на эхокардиографию, которая выявила большой дефект межпредсердной перегородки размером 11 мм без каких-либо осложнений. Врач не назначил закрытие дефекта и назначил повторный визит для регулярного наблюдения.
Через полгода у Трюк появились признаки медленного набора веса, а в некоторые месяцы она даже немного похудела. Она часто болела респираторными инфекциями и плохо питалась. При контрольном обследовании в 11 месяцев эхокардиограмма выявила расширение правых камер сердца, которое прогрессировало по сравнению с предыдущим обследованием.
«Сочетание симптомов и эхокардиограммы показывает, что дефект межпредсердной перегородки вызвал осложнения, требующие раннего парашютного вмешательства для закрытия дефекта», — сказал доктор Туй.
Доктор Ву Нанг Фук, который непосредственно лечил пациентку, оценил, что это вмешательство было достаточно сложным, поскольку у Трук был недостаточный вес (8,4 кг на момент вмешательства), а ее отверстие было более 10 мм, поэтому для его полного закрытия требовался большой зонт.
Однако у детей с недостатком веса, если парашют слишком большой, он может легко сдавить окружающие органы, вызывая регургитацию митрального или трикуспидального клапана. Кроме того, небольшое правое предсердие расширяется, уменьшая размер левого предсердия, что затрудняет операцию из-за узкого пространства камеры сердца, что затрудняет раскрытие парашюта и точное закрытие отверстия.
Чтобы решить проблему, доктор Фук и его команда попытались использовать самый маленький парашют (диаметром 12 мм), чтобы полностью закрыть отверстие, не повредив сердечный клапан. На протяжении всего вмешательства рентгеновские снимки и чреспищеводная эхокардиография помогали врачу точно выполнить процедуру. Через 45 минут процедура была успешно завершена.
Послеоперационная эхокардиография показала, что отверстие затянулось и не сдавливало окружающие структуры. Ребёнок был выписан через день после вмешательства.
По словам доктора Фука, парашютная окклюзия дефекта межпредсердной перегородки является методом выбора при наличии дефекта с подходящей анатомической структурой. Это малоинвазивный метод вмешательства, обладающий рядом преимуществ, таких как безопасность, меньшая кровопотеря, меньшая болезненность, снижение риска инфицирования, быстрое восстановление и отсутствие необходимости в разрезе грудной клетки, что исключает образование рубцов.
Дети могут вернуться к привычному образу жизни сразу после вмешательства. При успешном закрытии отверстия и хорошем уходе после вмешательства ребёнок полностью восстановится и будет развиваться как обычный ребёнок.
Врожденный порок сердца можно в некоторой степени предотвратить, сделав прививку от краснухи (кори), избегая приема лекарств, не назначенных врачом, в течение первых трех месяцев беременности, а также избегая употребления алкоголя и наркотиков во время беременности...
По сравнению с другими врождёнными пороками сердца, дефект межпредсердной перегородки часто диагностируется на поздних стадиях. Доктор Туй отметил, что Трук была обнаружена на ранней стадии, поскольку у неё проявились ранние симптомы из-за большого отверстия.
Если ребенок бледный, сильно потеет, у него холодные руки и ноги, он медленно набирает вес, у него учащенное дыхание, хрипы или рецидивирующие респираторные инфекции, родителям следует отвести ребенка в специализированное медицинское учреждение для скрининга врожденных пороков сердца.
Головная боль, бессонница, потеря аппетита из-за жировой дистрофии печени из-за избыточного веса
Г-же Л.П.Х. 36 лет, она офисная сотрудница в импортно-экспортной компании. Её работа в основном связана с вводом данных, ей приходится сидеть за компьютером по 6-7 часов в день, поэтому, несмотря на рост всего 1 метр 55 сантиметров, она довольно «полненькая» – весит около 76 килограммов.
Хотя она знала, что у нее лишний вес из-за плотного рабочего графика и нехватки времени, и видя, что ее здоровье по-прежнему в норме, она ограничила лишь потребление крахмала и меньше ела, не следуя какой-либо программе по снижению веса.
Периодически она ощущала боль и дискомфорт в правой верхней части живота, иногда теряла аппетит, а в последнее время мучилась головными болями и бессонницей. В конце года, во время планового медицинского осмотра на предприятии, УЗИ брюшной полости показало у неё жировую дистрофию печени 2 степени.
Случайно она встретила своего бывшего одноклассника, который рассказал ей о своём методе лечения, направленном на уменьшение количества висцерального жира после того, как у неё обнаружили жировой гепатоз второй степени. «Тогда я узнала, что если не лечить жировой гепатоз, он может перейти в гепатит, цирроз и даже рак печени», — сказала г-жа Х. и решила пройти более тщательное обследование.
Результаты измерений InBody показали, что ее ИМТ составил 31,6 (кг/м²), ожирение 2 степени; уровень висцерального жира составил 162 см² (средний уровень ниже 100 см²), что находится в пределах порога плохого висцерального жира.
Количество жира, накопленного только в печени, составляет почти 20% от общей массы печени, что соответствует жировой дистрофии печени 2 степени. Врач объяснил, что чрезмерное увеличение веса и избыток висцерального жира увеличивают риск и тяжесть жировой дистрофии печени у г-жи Х.
Врач-специалист 2-го класса Труонг Тхи Вань Куен из Центра похудения Там Ань сказал, что в данном случае причиной усталости, болей в животе, головной боли и проблем со сном у пациента является жировая дистрофия печени 2-й степени.
Если жировая дистрофия печени сохраняется и не контролируется должным образом, это может привести к снижению функции печени и ее повреждению, что может привести к циррозу, гепатиту и даже раку печени.
Чем выше вес, тем больше накапливается висцерального жира, что приводит к риску возникновения ряда заболеваний, таких как жировая дистрофия печени, диабет, высокое кровяное давление и инсульт.
Накопленный висцеральный жир может поражать артерии, увеличивая нагрузку на сердечно-сосудистую систему. Это увеличивает риск инфаркта, инсульта и других сосудистых проблем, таких как бессонница, головные боли и потеря памяти.
При ожирении печень не может эффективно перерабатывать и выводить токсины из организма. Это приводит к накоплению токсинов в организме, вызывая усталость, головные боли и ухудшая качество сна.
С другой стороны, жировой гепатоз печени влияет на метаболизм питательных веществ, особенно липидов и сахаров, что приводит к гормональному и энергетическому дисбалансу в организме. Это может вызвать усталость, потерю аппетита, головные боли и т. д.
Врач назначил г-же Х. план лечения для снижения жировой прослойки с использованием пероральных и инъекционных препаратов в сочетании с диетой и режимом физических упражнений, соответствующими её работе и образу жизни. После контрольного визита через 2 месяца, хотя лечение ещё не было завершено, уровень висцерального жира в её организме был практически на безопасном уровне, а уровень жировой дистрофии печени снизился всего до 1.
По словам доктора Ван Кхуена, в норме жировая ткань здоровой печени составляет около 3–5% от её веса. Жировая дистрофия печени — это состояние, при котором количество жира, накопленного в печени, превышает 5% от её веса. Ультразвуковое исследование, основанное на феномене повышенной яркости печёночной паренхимы на изображении, позволяет врачу определить степень жировой дистрофии печени.
Для точной оценки пациентам следует провести более углубленные исследования, такие как анализы крови, исследования функции печени и более точные методы визуализации, такие как КТ, МРТ, измерения InBody и т. д., чтобы определить уровень жира в печени, а также количество висцерального жира в организме.
Доктор Куен объясняет, что употребление слишком большого количества калорийной и богатой углеводами пищи может привести к развитию инсулинорезистентности. Инсулинорезистентность влияет на регуляцию уровня сахара в крови, заставляя печень вырабатывать слишком много глюкозы (сахара).
В результате печень преобразует избыток глюкозы в жир и запасает его в печёночных клетках, вызывая жировой гепатоз. Это состояние называется неалкогольной жировой болезнью печени. В свою очередь, жировой гепатоз также вызывает и усугубляет инсулинорезистентность, замыкая «порочный круг».
Таким образом, снижение веса является «ключом» к контролю и лечению жировой дистрофии печени. «Снижение веса всего на 5–10% может помочь уменьшить количество жира в печени, снизить инсулинорезистентность, уменьшить воспаление, улучшить метаболизм липидов и улучшить функцию печени», — пояснил доктор Куен.
Однако ожирение печени встречается не только у людей с избыточным весом и ожирением. Доктор Хуен отметил, что у людей с нормальным весом, но нездоровым питанием и образом жизни, организму не хватает питательных веществ, что приводит к низкому уровню сахара в крови и усилению расщепления жира в энергию.
Это увеличивает количество жирных кислот, поступающих в кровь, что приводит к накоплению жира в печени. Если вы ленитесь, жир будет накапливаться в печени и не будет метаболизироваться, что со временем может привести к жировой дистрофии печени.
Врачи рекомендуют пациенту при прохождении медицинского осмотра, если результаты УЗИ брюшной полости показывают жировую дистрофию печени, обратиться за специализированным обследованием.
«В настоящее время самый точный, простой и недорогой способ определения висцерального жира — это измерение InBody. В зависимости от уровня висцерального жира у каждого пациента врач даст соответствующие рекомендации и рекомендации по лечению», — сказал доктор Куен.
Источник: https://baodautu.vn/tin-moi-y-te-ngay-142-hoi-sinh-nguoi-benh-mac-ung-thu-phoi-d246348.html




















































![[Морские новости] Более 80% мировых контейнерных перевозок находится в руках MSC и крупных судоходных альянсов.](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/7/16/6b4d586c984b4cbf8c5680352b9eaeb0)











































Комментарий (0)