En la sesión de la tarde del 21 de noviembre de la VIII sesión de la XV Asamblea Nacional , con el acuerdo de la mayoría de los delegados, la Asamblea Nacional aprobó oficialmente la Ley que modifica y complementa varios artículos de la Ley de Farmacia.

Con el 88,94% de los votos a favor de los delegados, la Ley que modifica y complementa varios artículos de la Ley de Farmacia fue aprobada oficialmente en la VIII sesión de la XV Asamblea Nacional.
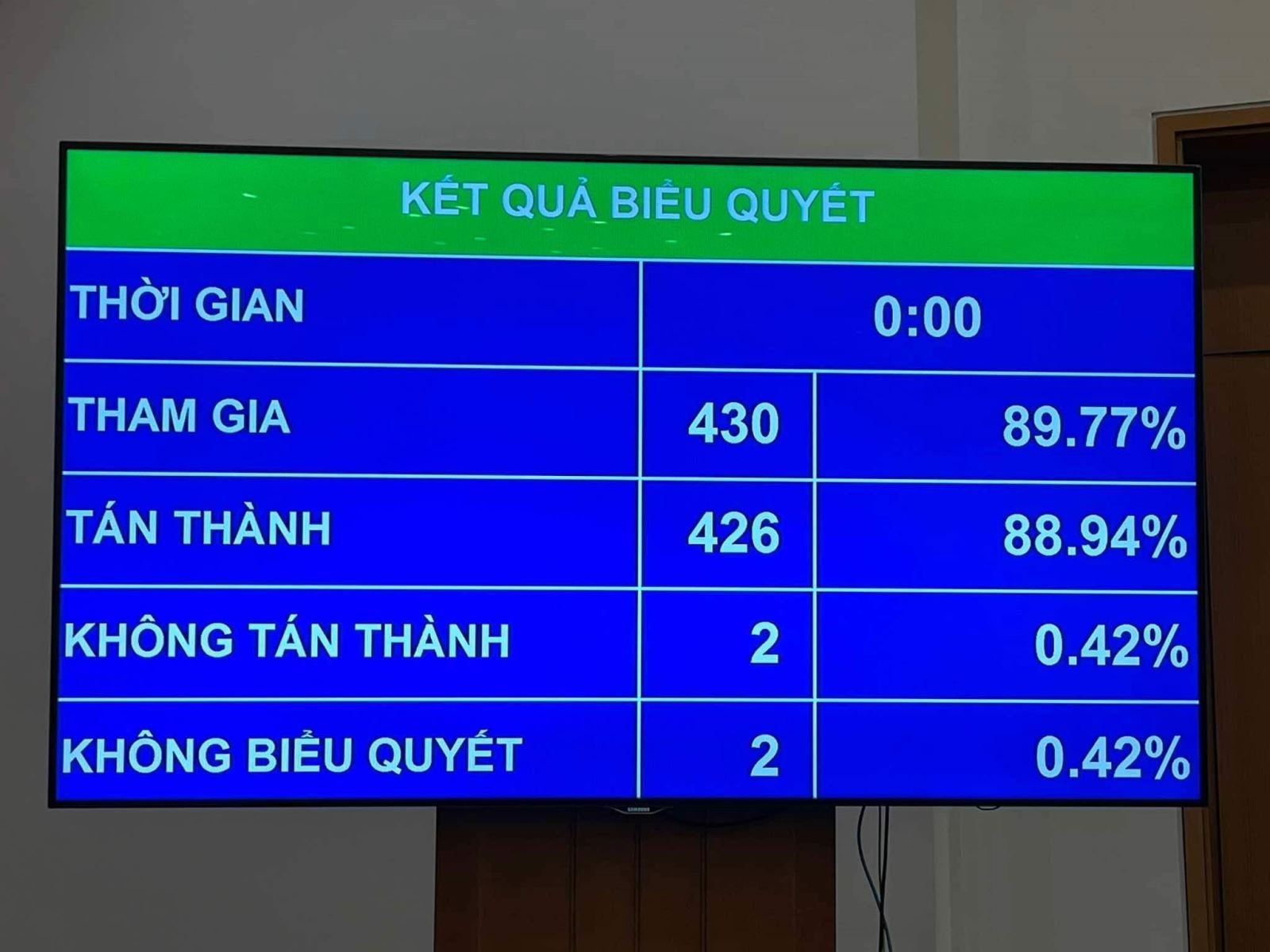
Antes de que los diputados de la Asamblea Nacional votaran para aprobar la totalidad del proyecto de Ley que modifica y complementa una serie de artículos de la Ley de Farmacia, la Asamblea Nacional votó para aprobar 2 contenidos de la Ley, incluidos:
Respecto a la Cláusula 23, Artículo 1 sobre los derechos y responsabilidades de los establecimientos organizadores de cadenas de farmacias y de las farmacias de la cadena de farmacias. El resultado de la votación fue 89,14% de delegados a favor.
Votación sobre la Cláusula 30, Artículo 1 sobre autoridad, registros, procedimientos, plazos para otorgar y renovar certificados de registro para la circulación de medicamentos e ingredientes farmacéuticos. El resultado de la votación fue 86,22% de delegados a favor.
Antes de la votación, la Sra. Nguyen Thuy Anh, Presidenta del Comité Social de la Asamblea Nacional, leyó el informe sobre la recepción, explicación y revisión del proyecto de ley que modifica y complementa varios artículos de la Ley de Farmacia.
Español Específicamente, con respecto a la política estatal sobre productos farmacéuticos y desarrollo de la industria farmacéutica (Artículos 7 y 8 (enmendados), teniendo en cuenta las opiniones de los delegados, el Comité Permanente de la Asamblea Nacional ordenó la revisión del Artículo 7 (enmendado) para asegurar que refleje el contenido principal de los principios; añadiendo las disposiciones "Existe una política para controlar el número de certificados de registro de circulación de medicamentos para medicamentos con los mismos ingredientes activos y materiales medicinales de acuerdo con las condiciones socioeconómicas en cada período" en la Cláusula 14 y "Priorizar la inversión en el desarrollo de infraestructura de tecnología de la información, implementando la transformación digital en las actividades farmacéuticas" en la Cláusula 15. Sin embargo, para que la política entre en práctica, especialmente las disposiciones de las Cláusulas 8, 13, 14, el Comité Permanente de la Asamblea Nacional quisiera solicitar permiso para asignar al Gobierno para especificar este Artículo en detalle.
Español Respecto a las políticas preferenciales y de apoyo a la inversión en el desarrollo industrial, con base en las opiniones de la mayoría de los delegados, el Comité Permanente de la Asamblea Nacional acordó con el Gobierno adoptar la Cláusula 1, Artículo 8 según la Opción 1, que consiste en permitir la aplicación de incentivos especiales y apoyo a la inversión a proyectos recientemente establecidos en el sector farmacéutico con un capital de inversión total de VND 3.000 billones o más, desembolsando al menos VND 1.000 billones dentro de los 3 años a partir de la fecha de otorgamiento del Certificado de Registro de Inversión o aprobación de la política de inversión. Al mismo tiempo, para garantizar la coherencia de las políticas preferenciales y el apoyo especial a la inversión en el sector farmacéutico, el Comité Permanente de la Asamblea Nacional solicitó al Gobierno que preste atención a la expresión de incentivos fiscales al modificar las leyes fiscales y leyes relacionadas, incluido el proyecto de Ley del Impuesto sobre la Renta de las Sociedades (enmendado).
Español Con respecto al negocio de la cadena de farmacias (Artículo 17a (complementado); Artículos 31, 32, 33, 36, 37 y 38 (enmendados); Artículo 47a (complementado); con base en las opiniones de los delegados, el Comité Permanente de la Asamblea Nacional revisó y revisó las disposiciones sobre las cadenas de farmacias; incluyendo el contenido de asignar al Ministro de Salud para regular la rotación de personas responsables de la experiencia farmacéutica entre las farmacias en la cadena como se muestra en el Punto g, Cláusula 2, Artículo 47a (complementado); regular la responsabilidad de las farmacias en la cadena de suspender temporalmente las operaciones en caso de que la instalación de la organización de la cadena de farmacias suspenda temporalmente las operaciones durante 6 meses o más (Punto d, Cláusula 4, Artículo 47a (complementado), y terminar las operaciones cuando la instalación de la organización de la cadena de farmacias cese las operaciones (Punto d, Cláusula 4, Artículo 47a (complementado).
Sobre el comercio de medicamentos e ingredientes farmacéuticos a través del comercio electrónico (artículos 6, 32 y 42 (modificados)); Con base en las opiniones de los delegados, para asegurar una gestión oportuna de las situaciones que puedan surgir en la práctica, además de los derechos y responsabilidades prescritos en el proyecto de Ley, el Comité Permanente de la Asamblea Nacional ha agregado una cláusula que estipula que los establecimientos comerciales farmacéuticos que utilizan métodos de comercio electrónico deben cumplir con las regulaciones del Gobierno sobre la venta al por mayor de medicamentos, ingredientes farmacéuticos y la venta al por menor de medicamentos mediante métodos de comercio electrónico en el Punto h, Cláusula 4, Artículo 42 (enmendado). Al mismo tiempo, resuma las regulaciones sobre los derechos y responsabilidades de los establecimientos comerciales farmacéuticos cuando realizan negocios mediante el método de comercio electrónico en la Cláusula 4, Artículo 42 (enmendado).
En relación con la expedición, prórroga, cambio y complementación de los Certificados de Registro de Circulación de Medicamentos (Artículo 56 (enmendado); implementando el principio de pensamiento innovador en la construcción legislativa, el Comité Permanente de la Asamblea Nacional ha revisado el contenido enmendado del Artículo 56 en la dirección de no regular específicamente en la Ley sino encargar al Ministro de Salud que especifique los expedientes y procedimientos para la expedición, prórroga, cambio y complementación de los certificados de registro de circulación de medicamentos e ingredientes farmacéuticos en el Artículo 56.
Además, aceptando las opiniones de los delegados que sugieren estudiar y complementar las regulaciones para limitar la emisión de nuevos certificados de registro de circulación para medicamentos con superposición, para limitar la explotación de políticas para "reservar" el registro para licencias de circulación debido a las bajas tarifas de licencia, en el futuro inmediato, la Cláusula 7, Artículo 56 (enmendado) estipula que el certificado de registro de circulación para medicamentos que no han circulado en el mercado durante 5 años no se extenderá. Al mismo tiempo, la cláusula 14, artículo 7 (enmendado) estipula que el Estado tiene una política para controlar el número de certificados de registro de circulación de medicamentos para medicamentos con el mismo ingrediente activo y hierbas medicinales y encarga al Gobierno proporcionar regulaciones detalladas.
Respecto de la gestión de precios de medicamentos (explicación de términos en cláusulas 44, 45, 46 y 47, Artículo 2 (enmendado); artículos 107, 109, 110, 112 y 113 (enmendados); derogación del Artículo 114): Incorporando las opiniones de los delegados, el Comité Permanente de la Asamblea Nacional revisó y acordó la propuesta del Gobierno sobre la regulación de las medidas para anunciar los precios al por mayor que se espera se apliquen a los medicamentos de prescripción. Se trata de una medida específica en la gestión de precios de medicamentos, ya que los medicamentos con receta representan una gran proporción del mercado, se utilizan ampliamente en los centros médicos y los pacientes deben comprarlos según prescripción médica. Además, el Ministerio de Salud recomienda a las empresas farmacéuticas el precio mayorista esperado de los medicamentos para limitar los aumentos de precios de los medicamentos a través de cada nivel, nivel intermedio y aumentar los precios al llegar a los consumidores. Al mismo tiempo, mantener las regulaciones actuales sobre el margen máximo de venta minorista de medicamentos vendidos en establecimientos de venta minorista de medicamentos dentro de las instalaciones de exámenes y tratamientos médicos.
Respecto a la propuesta de los delegados sobre las medidas de declaración de precios, dado que este contenido se implementa de acuerdo con la ley de precios, el Comité Permanente de la Asamblea Nacional propuso que el Gobierno revise los documentos rectores y los reglamentos detallados de la Ley de Precios de 2023 para complementar los reglamentos sobre los criterios de selección de la lista de establecimientos obligados a declarar precios, asegurando una implementación consistente y transparente en las localidades; Al mismo tiempo, supervisar de cerca el proceso de implementación, detectar rápidamente dificultades y problemas para su manejo; Se solicita al Ministerio de Salud actualizar periódicamente el Listado de Medicamentos Esenciales para asegurar una orientación completa de acuerdo a lo establecido en la ley sobre precios.
EspañolCon respecto a las disposiciones de implementación (Artículo 3): En respuesta a las opiniones de los delegados, el Comité Permanente de la Asamblea Nacional ha revisado el efecto de implementación y las disposiciones transitorias como se muestra en el Artículo 3 del proyecto de Ley, en consecuencia, la Ley entra en vigor a partir del 1 de julio de 2025 (Cláusula 1, Artículo 3) y solo se aplica a partir del 1 de enero de 2025 a las disposiciones sobre la extensión del certificado de registro para la circulación de medicamentos e ingredientes farmacéuticos, y las disposiciones sobre la venta al por mayor de medicamentos e ingredientes farmacéuticos por establecimientos de fabricación, importación y venta al por mayor de medicamentos (Cláusula 2, Artículo 3) para superar de inmediato las dificultades en el negocio farmacéutico.
Las opiniones de los diputados de la Asamblea Nacional fueron estudiadas seriamente, absorbidas en su totalidad y el proyecto de Ley fue revisado en contenidos específicos como: (i) los conceptos de "medicamentos sin receta" y "medicamentos de alta tecnología"; (ii) estipular que la persona responsable de la pericia farmacéutica en la organización de la cadena de farmacias debe tener título de farmacéutico y tener 02 años de práctica profesional en una instalación de farmacia adecuada; (iii) garantizar la transparencia y la coherencia de las reglamentaciones sobre los derechos de los establecimientos de fabricación, los establecimientos de exportación e importación, los establecimientos mayoristas de medicamentos e ingredientes farmacéuticos y las empresas farmacéuticas con inversión extranjera; (iv) permitir que los centros de examen y tratamiento médico importen medicamentos que no tengan un certificado de registro de circulación en Vietnam para atender las necesidades de tratamiento especial de los pacientes del centro en el Punto i, Cláusula 2, Artículo 60 y encargar al Gobierno que especifique en detalle la transferencia de medicamentos en el Punto d, Cláusula 7, Artículo 60; (v) Asignar al Ministro de Salud la tarea de prescribir la forma y el método de información sobre medicamentos (en lugar del Gobierno como actualmente) y revisar la redacción, el estilo y las técnicas legislativas en la mayoría de los artículos y cláusulas del proyecto de ley.
El proyecto de Ley revisado consta de 3 artículos, de los cuales el artículo 1 modifica 50 artículos, suprime 2 puntos, 2 incisos y 1 artículo de la actual Ley de Farmacia y añade 3 artículos nuevos; El artículo 2 modifica y complementa el Anexo Nº 01 emitido conjuntamente con la Ley de Precios Nº 16/2023/QH15; Artículo 3 sobre Condiciones de Implementación.
Los contenidos de recepción, explicación y ajuste se presentan específicamente en el Informe No. 1062 con 06 contenidos principales, 10 contenidos específicos y otros contenidos.
En comparación con la Ley actual, el proyecto de Ley tiene siete nuevos grupos básicos de puntos como sigue:
La política estatal en materia farmacéutica continúa perfeccionándose, institucionalizando los puntos de vista del Partido con el objetivo de desarrollar la industria farmacéutica vietnamita como una industria de punta. En consecuencia, el proyecto de Ley añade una serie de disposiciones más innovadoras en comparación con la Ley de Farmacia de 2016 para atraer inversiones y promover aún más la investigación y el desarrollo de la producción de medicamentos e ingredientes farmacéuticos, como políticas preferenciales en los procedimientos administrativos al otorgar certificados de registro de circulación y licencias de importación; políticas para aplicar mecanismos preferenciales y apoyos de fondos de apoyo a actividades científicas y tecnológicas en investigación, desarrollo, ensayos clínicos, transferencia de tecnología, producción de medicamentos e ingredientes farmacéuticos; Políticas de mantenimiento y reducción de precios para algunos grupos de medicamentos con transferencia de tecnología de producción; política de transformación digital en las actividades farmacéuticas; Determinar la escala de los proyectos en el sector farmacéutico que son elegibles para incentivos y apoyo especial a la inversión, y encargar al Gobierno que proporcione reglamentación detallada para garantizar la viabilidad y dar vida a las políticas del Estado sobre productos farmacéuticos y desarrollo de la industria farmacéutica.
Creación de un corredor jurídico para nuevas formas y métodos comerciales, que son: (i) regular el establecimiento de una cadena de farmacias como un tipo separado de establecimiento comercial farmacéutico, las condiciones comerciales, los derechos y responsabilidades del establecimiento de una cadena de farmacias, las farmacias en la cadena de farmacias, en particular el derecho a rotar medicamentos y el derecho a rotar a las personas responsables de la experiencia farmacéutica entre las farmacias de la cadena de farmacias; (ii) la reglamentación sobre el comercio de medicamentos e ingredientes farmacéuticos mediante comercio electrónico, en particular, la reglamentación complementaria sobre medios electrónicos y tipos de medicamentos e ingredientes farmacéuticos cuyo comercio electrónico permite; complementar los derechos y responsabilidades de los establecimientos de actividad farmacéutica conforme a este método.
Especificar los derechos y responsabilidades de las empresas farmacéuticas con inversión extranjera en la Ley para garantizar la publicidad y la transparencia en la gestión estatal.
Ampliar los derechos de los establecimientos de fabricación, los establecimientos de exportación e importación y los establecimientos mayoristas de medicamentos e ingredientes farmacéuticos para vender directamente a una serie de instalaciones médicas, instalaciones de rehabilitación de drogas, instalaciones de prueba, instalaciones de investigación y capacitación y una serie de otras instalaciones; Permitir que los centros de examen y tratamiento médico importen medicamentos para atender las necesidades de tratamiento especiales de los pacientes en dichos centros.
Promover la reforma del procedimiento administrativo en el registro de circulación de medicamentos e ingredientes farmacéuticos con el fin de clasificar los medicamentos e ingredientes farmacéuticos en función de los diferentes niveles de propiedades farmacológicas, así como la circulación para ajustar los registros, procedimientos, plazos para otorgar, extender, cambiar y complementar los certificados de registro de circulación de medicamentos e ingredientes farmacéuticos en consecuencia, para aumentar la capacidad de acceso temprano a los medicamentos para las personas y al mismo tiempo garantizar la eficacia de la gestión estatal, el control de calidad, la seguridad y la eficacia de los medicamentos; Reglamento complementario para limitar la emisión de números de registro de circulación duplicados. Al mismo tiempo, existen regulaciones específicas sobre registros y procedimientos para registrar medicamentos, ingredientes de medicamentos, pruebas de medicamentos y comercio de medicamentos en general para cumplir con los requisitos de defensa nacional, seguridad, desastres naturales, catástrofes y epidemias.
Abolir el procedimiento para confirmar el contenido de la información de los medicamentos. Fortalecer la descentralización, la delegación de autoridad, promover el papel del Departamento de Salud en el retiro y manejo oportuno de medicamentos que violan la calidad en el área de gestión, garantizando el uso seguro y efectivo de los medicamentos.
Prescribir medidas de gestión de precios para cumplir con la Ley de Precios y medidas específicas en la gestión de precios de medicamentos son anunciar y volver a anunciar los precios mayoristas esperados aplicables a los medicamentos recetados, asegurando que la venta al por mayor de medicamentos a través de niveles intermediarios no exceda los precios mayoristas esperados anunciados.
VNA
[anuncio_2]
Fuente: https://baohanam.com.vn/chinh-tri/nguoi-dai-bieu-nhan-dan/quoc-hoi-chinh-thuc-thong-qua-luat-duoc-sua-doi-140545.html


![[Foto] El Primer Ministro Pham Minh Chinh recibe al rabino Yoav Ben Tzur, Ministro de Trabajo de Israel.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/21/511bf6664512413ca5a275cbf3fb2f65)


![[Foto] Taller científico "Construyendo un modelo socialista asociado con el pueblo socialista en la ciudad de Hai Phong en el período 2025-2030 y años posteriores"](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/21/5098e06c813243b1bf5670f9dc20ad0a)
![[Foto] Llegando a Son La, vamos a "lucirnos" con los Wallflowers](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/21/627a654c41fc4e1a95f3e1c353d0426d)
![[Foto] El primer ministro Pham Minh Chinh recibe al presidente de la región Asia-Pacífico del Grupo PowerChina](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/21/0f4f3c2f997b4fdaa44b60aaac103d91)






















































































Kommentar (0)