현재 베트남의 임상 시험은 대부분 약물, 백신, 의료 장비, 새로운 치료 기술 등 새로운 제품을 개발하기 위한 시험입니다. 특히, 최근에는 세포 및 유전자 치료에 대한 연구가 진행되고 있습니다.
임상시험은 시행하기 전에 승인을 받고 면밀히 평가되어야 합니다. 시험 과정, 새로운 제품 및 기술은 연구에 참여하는 자원봉사자에게 위험을 초래할 수 있기 때문입니다.
그러나 실제로는 보건부 외의 다른 부처 및 부문에서 인간을 대상으로 연구를 수행하도록 승인했지만 생물의학 연구 윤리 위원회의 승인을 받지 않은 연구도 수년에 걸쳐 있었습니다.
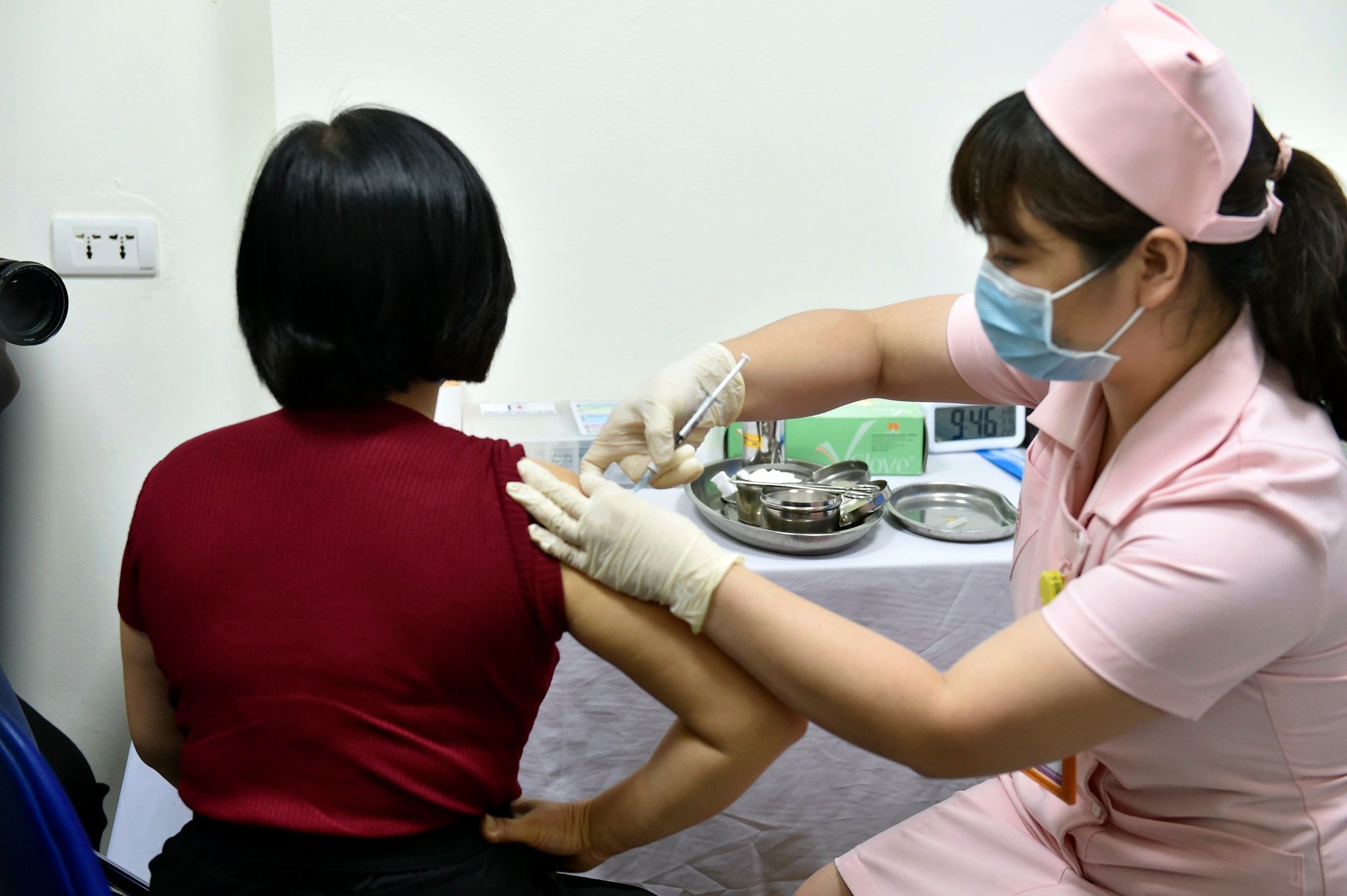
2021년 3월 하노이 의대에서 진행된 코로나19 백신 코비백(Covivac)의 실험적 투여
보건부는 보건부 관할 과학기술업무 관리를 규정하는 회람 초안에 대한 의견을 수렴하고 있습니다. 이 초안은 예산 외 재원으로 지원받고 다른 부처 및 부문에서 관리하지만 인체 연구를 포함하는 연구 주제는 생물의학연구윤리위원회의 승인과 보건부의 승인을 받은 후에만 수행할 수 있도록 규정하고 있습니다. 동시에, 이 초안은 연구 개요 승인, 보건부의 승인 기간 단축, 연구 진행 보장에 있어 각 부서의 풀뿌리 위원회의 역할을 강조하고 장려합니다.
베트남에서는 매년 약 100건의 임상 시험이 실시되고 있으며, 이는 베트남이 치료 및 건강 관리, 특히 암, 심혈관 질환 등과 같은 어려운 질병에 대한 새로운 기술, 제품 및 방법에 접근하는 데 유리한 요소입니다. 새로운 제품과 기술이 승인되면 베트남은 약물, 백신 등을 포함하여 이러한 제품에 조기에 접근할 수 있는 곳이 될 것입니다. 그러나 정식 허가를 받기 전에 임상 시험 과정은 자원 봉사자의 건강과 생명에 위험을 초래할 수 있으므로 시행 중에 엄격한 승인 및 모니터링이 필요합니다.
현행 규정에 따라 보건부는 인간 피험자를 대상으로 하는 생물의학 연구의 시행을 관리, 지도 및 조직할 책임이 있습니다. 인간 피험자를 대상으로 하는 생물의학 연구와 관련된 과학기술 업무를 시행하기 전에, 해당 업무를 담당하는 기관은 생물의학 연구 윤리위원회의 승인을 받아야 합니다(회람 제04/2020/TT-BYT호 규정에 의거).
[광고_2]
소스 링크






















![[사진] 국회의장 쩐탄만, 베트남 영웅 모친 타티쩐 방문](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/7/20/765c0bd057dd44ad83ab89fe0255b783)










































































댓글 (0)