Podle profesora Dr. Le Van Quanga, ředitele nemocnice K, bude na tomto oddělení brzy zavedena Léčba pembrorie v léčebném režimu pro pacienty s rakovinou. Vyrábí se lék Pembroria (Rusko), jehož cena za lahvičku je přibližně 18 milionů VND, pacienti obvykle užívají dvě lahvičky v jedné kúře. Léčebná kúra trvá 12 až 24 cyklů, nebo dokud pacient na lék nepřestane reagovat. V současné době není lék hrazen zdravotním pojištěním.
Podle zástupce Úřadu pro kontrolu léčiv ( Ministerstva zdravotnictví ) dokončil přípravek Pembroria klinické studie a získal oficiální licenci k prodeji ve Vietnamu. Léčivo vyrábí ruská společnost Biocad a je registrováno společností se sídlem v SAE. Licence umožňuje dovoz, distribuci a široké užívání léku a nepatří do skupiny speciálních nebo omezených léčiv.
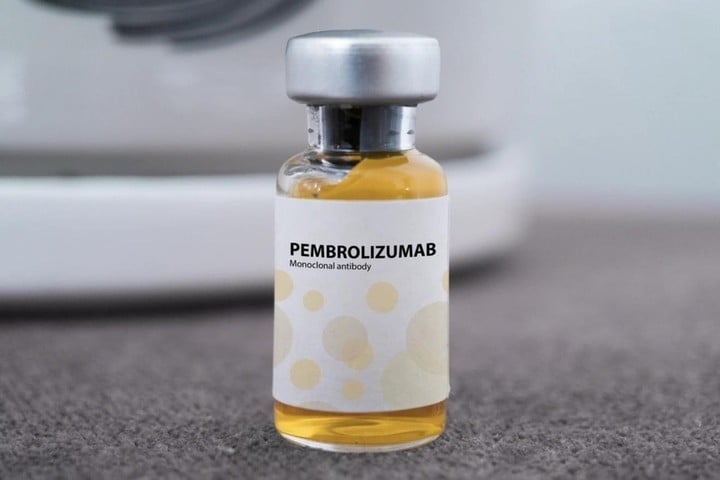
Pembroria je v podstatě „biosimilární“ přípravku Keytruda – původního produktu vyvinutého společností MSD (USA), který také obsahuje účinnou látku pembrolizumab. Jedná se o monoklonální protilátku, která pomáhá imunitnímu systému rozpoznávat a ničit rakovinné buňky a je považována za jednu z nejúčinnějších imunoterapií současnosti. Keytruda byla v USA schválena v roce 2014 a ve Vietnamu povolena k uvedení na trh v roce 2017.
Očekává se, že výskyt Pembrorie otevře pacientům s rakovinou lepší přístup k léčbě, a to za výrazně nižší cenu – přibližně 18 milionů VND za lahvičku, oproti 55–65 milionům VND za Keytrudu. Ani jeden z těchto léků však stále není hrazen zdravotním pojištěním.
Pembrolizumab funguje na principu „rychlého uvolňování“ do T imunitních buněk. Za normálních okolností rakovinné buňky vysílá signál „stop“, který brání T buňkám v útoku. Lék tento signál blokuje a reaktivuje tak schopnost ničit nádory, což je účinné u mnoha typů rakoviny, jako je rakovina plic, ledvin, děložního čípku, melanom...
Podle Úřadu pro kontrolu léčiv (Drug Administration) předložil podnik celou dokumentaci k licenci k uvedení léčiva na trh v souladu s předpisy. Do roku 2024 byly u tohoto léku dokončeny klinické studie. Podnik však nadále prováděl hodnocení imunogenicity – povinný požadavek pro biosimilární léky, jako je tento produkt, nikoli novou klinickou studii.
Během procesu oběhu jsou podniky zodpovědné za sledování a pravidelné podávání zpráv o bezpečnosti, účinnosti a imunogenitě léčiva po 3 nebo 5 letech, dle požadavků řídícího orgánu.
Dříve bylo v zemi povoleno k oběhu mnoho léků obsahujících účinnou látku pembrolizumab. Rozhodnutí 628/QD-QLD ze dne 31. října Úřadu pro kontrolu léčiv (Drug Administration) schválilo 14 vakcín a biologických produktů, včetně koncentrovaného infuzního roztoku Pembroria (100 mg/4 ml), s datem expirace 24 měsíců od data výroby.
Zdroj: https://baolangson.vn/thuoc-ung-thu-pembroria-cua-nga-vua-duoc-cap-phep-tai-viet-nam-co-gia-bao-nhieu-5064810.html






![[Foto] „Jizvy“ hor a lesů Da Nangu po bouřích a povodních](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1762996564834_sl8-jpg.webp)
![[Fotografie] Generální tajemník To Lam navštívil projekt mezinárodního letiště Long Thanh](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/13/1763008564398_vna-potal-tong-bi-thu-to-lam-tham-du-an-cang-hang-khong-quoc-te-long-thanh-8404600-1261-jpg.webp)



















































































![Přechod Dong Nai OCOP: [Článek 3] Propojení cestovního ruchu se spotřebou produktů OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)







Komentář (0)