Τα τελευταία χρόνια, μια σημαντική αλλαγή στην κατανόησή μας για τον καρκίνο ήταν η συνειδητοποίηση ότι οι μικροοργανισμοί δεν βρίσκονται μόνο στο έντερο αλλά και στον καρκινικό ιστό - συμπεριλαμβανομένων των συμπαγών όγκων όπως ο μαστός, ο προστάτης και ο πνεύμονας. Αυτές οι μικροβιακές κοινότητες (συλλογικά ονομάζονται ενδοογκικό μικροβίωμα ή μικροβίωμα που σχετίζεται με τον όγκο) αλληλεπιδρούν άμεσα με τα καρκινικά κύτταρα, τα κύτταρα του ανοσοποιητικού συστήματος και το περιβάλλον, επηρεάζοντας έτσι τη βιολογία του όγκου, την ανταπόκριση στη θεραπεία και την πρόγνωση.
Είναι η μικροχλωρίδα στον καρκινικό ιστό διαφορετική από την εντερική μικροχλωρίδα;
Ο καρκινικός ιστός θεωρούνταν προηγουμένως μια «στείρα ζώνη», αλλά πρόσφατη γονιδιωματική ανάλυση και ανάλυση αλληλουχίας αποκάλυψε μικροβιακό DNA/RNA σε πολλά δείγματα όγκων που έχουν αφαιρεθεί. Αυτά τα μικρόβια μπορεί να βρίσκονται μέσα σε καρκινικά κύτταρα, μέσα σε κύτταρα του ανοσοποιητικού συστήματος ή να είναι ενσωματωμένα στον περιβάλλοντα συνδετικό ιστό. Η σύνθεση και η πυκνότητα των μικροβίων ποικίλλουν μεταξύ των τύπων όγκων και των ασθενών - για παράδειγμα, οι όγκοι του μαστού έχουν σχετικά υψηλή μικροβιακή ποικιλομορφία σε σύγκριση με ορισμένους άλλους όγκους - και η θέση τους (ενδοκυτταρική έναντι εξωκυτταρικής) καθορίζει τον τρόπο με τον οποίο επηρεάζουν τον νοσούντα ιστό.
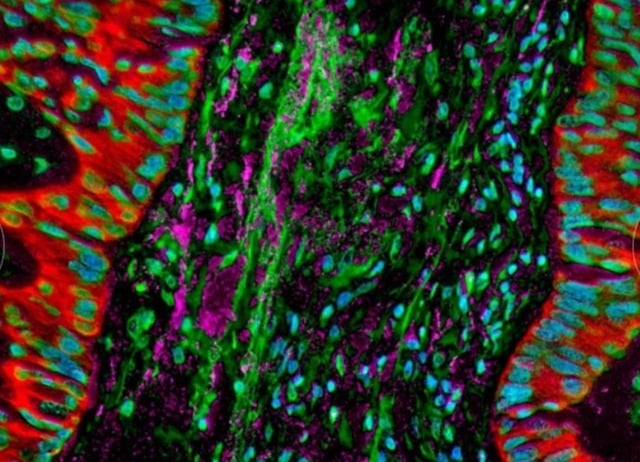
Οι μικροσκοπικές εικόνες δείχνουν βακτήρια που κατοικούν σε καρκινικά κύτταρα του πνεύμονα, μεταβάλλοντας την ανοσολογική απόκριση του οργανισμού.
Ο ρόλος των βακτηρίων και των ιών στον ιστό του μαστού, του προστάτη και των πνευμόνων
Η τοπική μικροχλωρίδα μπορεί να τροποποιήσει το ανοσοποιητικό περιβάλλον είτε με κατασταλτικό είτε με ενεργοποιητικό τρόπο. Ορισμένα μικρόβια ενεργοποιούν χρόνια φλεγμονώδη σήματα (π.χ., μέσω υποδοχέων αναγνώρισης προτύπων όπως οι TLRs), οδηγώντας σε αυξημένες προφλεγμονώδεις κυτοκίνες, οι οποίες προσελκύουν κατασταλτικά ανοσοκύτταρα (μακροφάγα M2, Tregs) — βοηθώντας έτσι τους όγκους να αποφύγουν την ανοσία. Αντίθετα, ορισμένα βακτήρια ή ιοί μπορούν να διεγείρουν την κυτταρική ανοσία (αυξημένη παρουσίαση αντιγόνου, ενεργοποίηση CD8+ Τ κυττάρων) και να συμβάλουν στην αποτελεσματικότητα της ανοσοθεραπείας. Έτσι, η ίδια μικροχλωρίδα μπορεί να είναι «φίλος» ή «εχθρός» ανάλογα με το πλαίσιο.
Ορισμένα βακτήρια παράγουν τοξίνες ή ενώσεις που βλάπτουν το DNA, προκαλώντας μεταλλάξεις και προωθώντας την εξέλιξη του καρκίνου. Αντίθετα, άλλα μικρόβια μπορούν να προκαλέσουν μεταβολισμό που μειώνει την ανάπτυξη των καρκινικών κυττάρων. Στον ιστό του μαστού, μελέτες έχουν τεκμηριώσει την παρουσία βακτηρίων που εμπλέκονται σε φλεγμονώδεις και μεταβολικές οδούς. Στον προστάτη, οι μικροβιακές αλλαγές σχετίζονται με την εξέλιξη της νόσου και την απόκριση στην αντιανδρογονική θεραπεία. Και στον πνεύμονα, το ενδογενές μικροβίωμα μπορεί να αλληλεπιδράσει με τη φλεγμονή που προκαλείται από το κάπνισμα και να τροποποιήσει το μικροπεριβάλλον, καθιστώντας τους όγκους λιγότερο ευαίσθητους στην ανοσοθεραπεία.
Η παρουσία ή η σύνθεση του ενδοογκικού μικροβιώματος μπορεί να μεταβάλει την αποτελεσματικότητα της χημειοθεραπείας, της ακτινοθεραπείας και ιδιαίτερα της ανοσοθεραπείας. Οι μηχανισμοί περιλαμβάνουν μεταβολές του μικροπεριβάλλοντος (pH, διατροφή), τοπική απενεργοποίηση φαρμάκων (ορισμένα βακτήρια διαθέτουν ένζυμα που αποικοδομούν φάρμακα) ή τροποποίηση της παρουσίασης αντιγόνου και της διείσδυσης των ανοσοκυττάρων. Αρκετές μελέτες έχουν δείξει ότι οι διαφορές στο μικροβίωμα του όγκου σχετίζονται με την απόκριση ή την αντίσταση στους αναστολείς των ανοσολογικών σημείων ελέγχου (ICIs).
Τοπική τροποποίηση μικροβιώματος σε καρκινικό ιστό - υφιστάμενες και ερευνητικές στρατηγικές
Η ιδέα της άμεσης παρέμβασης στο μικροβίωμα του όγκου ανοίγει νέους δρόμους θεραπείας. Ορισμένες από τις προσεγγίσεις που έχουν αναπτυχθεί ή βρίσκονται υπό ανάπτυξη περιλαμβάνουν:
Σε ορισμένα πειραματικά μοντέλα, η χρήση αντιβιοτικών για την εξάλειψη των «κακών» ειδών σε όγκους έχει αλλάξει τις αντιδράσεις των ιστών στα φάρμακα. Ωστόσο, τα συστηματικά αντιβιοτικά έχουν εκτεταμένες επιδράσεις (και μπορεί να διαταράξουν το μικροβίωμα του εντέρου που είναι απαραίτητο για την ανοσία), επομένως η τοπική χρήση αντιβιοτικών ή η ανάπτυξη αντιβιοτικών επιλεκτικών για τα είδη-στόχους αποτελεί προτεραιότητα.
Η ιδέα είναι να εισαχθούν τροποποιημένα βακτήρια στον καρκινικό ιστό που εκκρίνουν ανοσοδιεγερτικές κυτοκίνες, μεταβολικά ένζυμα που μεταβάλλουν το pH ή ένζυμα που διασπούν ανοσοκατασταλτικά. Ορισμένες προκλινικές δοκιμές που χρησιμοποιούν εξασθενημένα βακτήρια για την τοπική χορήγηση φαρμάκων έχουν δείξει πολλά υποσχόμενα αποτελέσματα.
Οι ογκολυτικοί ιοί έχουν μελετηθεί για την άμεση εξόντωση των καρκινικών κυττάρων και ταυτόχρονα για την διέγερση της αντικαρκινικής ανοσίας. Ο συνδυασμός ογκολυτικών ιών με την επεξεργασία του μικροβιώματος θα μπορούσε να ενισχύσει την τοπική ενεργοποίηση των Τ κυττάρων και να διευρύνει τις συστηματικές αποκρίσεις.
Αν και το θέμα εδώ είναι η τοπική μικροβιολογία, είναι σημαντικό να σημειωθεί ότι υπάρχει ένας άξονας εντέρου-όγκου: οι αλλοιώσεις στο μικροβίωμα του εντέρου (π.χ. μέσω της διατροφής, των προβιοτικών, της ενδοκοιλιακής μεταμόσχευσης (FMT) μπορούν έμμεσα να μεταβάλουν το ενδοογκικό μικροβίωμα και τη συστηματική ανοσία, επηρεάζοντας έτσι τον καρκινικό ιστό στον πνεύμονα, το μαστό ή τον προστάτη.

Οι επιστήμονες αναλύουν το μικροβιακό DNA σε ιστό όγκου για να βρουν είδη που επηρεάζουν την αποτελεσματικότητα της θεραπείας του καρκίνου.
Κλινικές προκλήσεις και προβληματισμοί
- Διάκριση μεταξύ «αιτίας» και «αποτελέσματος»: πολλές τρέχουσες μελέτες εξακολουθούν να περιγράφουν συσχετίσεις, αλλά δεν έχουν επιβεβαιώσει μια αιτιώδη σχέση μεταξύ της μικροβιολογίας και της εξέλιξης του όγκου.
- Τεχνική τυποποίηση: η δειγματοληψία, η απομόνωση DNA/RNA, η αποφυγή εξωγενούς μόλυνσης και η βιοπληροφορική ανάλυση απαιτούν τυποποίηση για αξιόπιστα αποτελέσματα.
- Υψηλή μεταβλητότητα μεταξύ των ασθενών: το μικροβίωμα εξαρτάται από το άτομο· οι παρεμβάσεις πρέπει να εξατομικεύονται.
- Ασφάλεια: Η εισαγωγή ζωντανών βακτηρίων ή ιών στον ιστό του όγκου ενέχει κίνδυνο μόλυνσης ή υπεραντίδρασης του ανοσοποιητικού συστήματος. Αυτές οι θεραπείες απαιτούν αυστηρές δοκιμές.
Η μελέτη του μικροβιώματος που σχετίζεται με τον όγκο ανοίγει ένα νέο επίπεδο βιολογίας στην ογκολογία: το τοπικό μικροβίωμα μπορεί να αποτελέσει τόσο υποκινητή του καρκίνου όσο και εργαλείο για την ανοσολογική τροποποίηση και τη στοχευμένη χορήγηση φαρμάκων σε όγκους. Με τις εξελίξεις στην αλληλούχιση, την ιστολογία, τη βιομίμηση και τις τεχνικές μικροβιωματικής μηχανικής, το εγγύς μέλλον υπόσχεται ότι οι θεραπευτικές στρατηγικές που στοχεύουν ή εκμεταλλεύονται το τοπικό μικροβίωμα - από βιοτεχνολογικά επεξεργασμένα βακτήρια, επιλεκτικούς φάγους έως ανοσοεπαρκείς ογκολυτικούς ιούς - θα γίνουν μέρος της πολυτροπικής θεραπείας.
Ωστόσο, η κλινική πορεία είναι ακόμη μακρά· η τυποποίηση των δοκιμών, η απόδειξη της αιτιότητας και η διασφάλιση της ασφάλειας θα αποτελέσουν προϋποθέσεις πριν από την ευρεία υιοθέτηση αυτών των παρεμβάσεων.
Πηγή: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm





























































































![Μετάβαση στο Dong Nai OCOP: [Άρθρο 3] Σύνδεση του τουρισμού με την κατανάλωση προϊόντων OCOP](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)













Σχόλιο (0)