Según las nuevas recomendaciones, Leqembi sólo se prescribirá a pacientes con Alzheimer en fase inicial que sean portadores del gen ApoE4, un factor de riesgo importante para la enfermedad de Alzheimer.
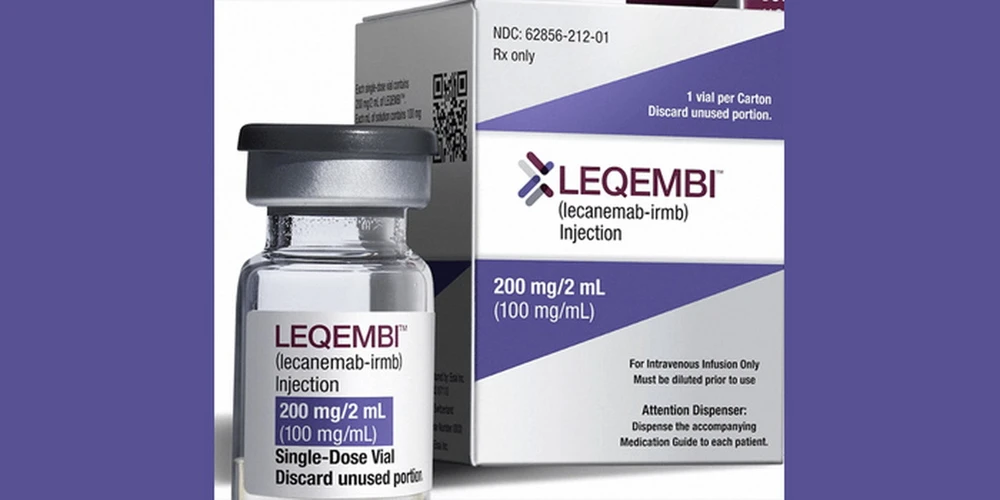
El 14 de noviembre, la Agencia Europea de Medicamentos (EMA) recomendó oficialmente la autorización de Leqembi para el tratamiento de la enfermedad de Alzheimer en fase inicial. Esta decisión marca un hito importante en la lucha contra esta enfermedad neurológica degenerativa.
La EMA había rechazado previamente Leqembi en julio debido a la preocupación por sus graves efectos secundarios, como la inflamación cerebral. Sin embargo, tras una evaluación más exhaustiva, el Comité de Medicamentos de Uso Humano (CHMP) de la EMA revocó su decisión.
Según las nuevas recomendaciones, Leqembi sólo se prescribirá a pacientes con Alzheimer en fase inicial que sean portadores del gen ApoE4, un factor de riesgo importante para la enfermedad de Alzheimer.
El estudio mostró que en este grupo de pacientes, los beneficios de Leqembi para retardar la progresión de la enfermedad superaron los riesgos.
La Comisión Europea tomará la decisión final sobre la concesión de la autorización de comercialización de Leqembi en toda la Unión Europea. Una vez aprobada, cada Estado miembro decidirá su propio precio y la cobertura del seguro médico para el medicamento.
Leqembi es un producto desarrollado y fabricado por dos compañías farmacéuticas líderes, Eisai (Japón) y Biogen (EE. UU.). El fármaco actúa eliminando las placas de beta-amiloide, una proteína tóxica que se acumula en el cerebro de los pacientes con Alzheimer.
[anuncio_2]
Fuente: https://www.vietnamplus.vn/eu-bat-den-xanh-cho-viec-su-dung-thuoc-leqembi-dieu-tri-alzheimer-post993619.vnp




































































































Kommentar (0)