새로운 권장 사항에 따라 Leqembi는 알츠하이머병의 중요한 위험 요소인 ApoE4 유전자를 보유한 초기 단계의 알츠하이머병 환자에게만 처방됩니다.
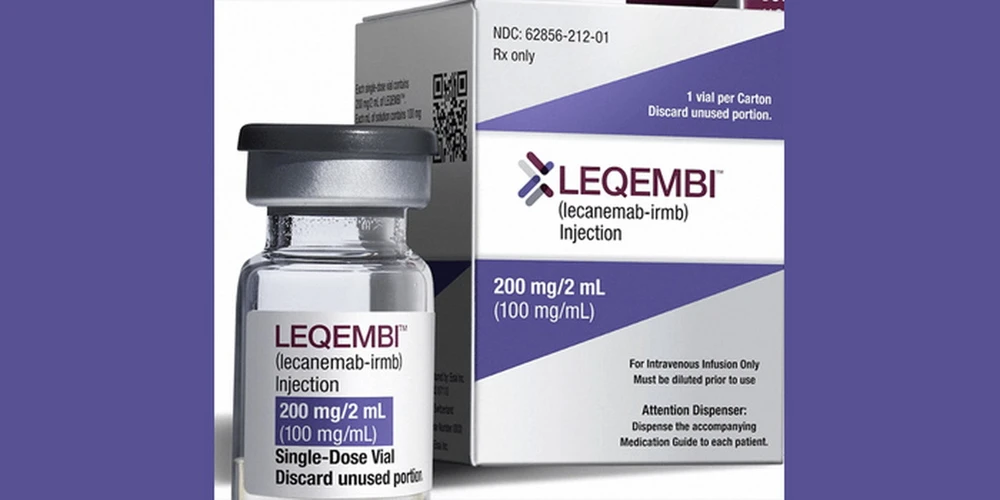
11월 14일, 유럽의약품청(EMA)은 레켐비(Leqembi)의 초기 알츠하이머병 치료제 허가를 공식 권고했습니다. 이번 결정은 이 퇴행성 신경 질환과의 싸움에서 중요한 이정표를 세웠습니다.
EMA는 앞서 7월에 뇌부종 등 심각한 부작용 우려로 레켐비의 판매 허가를 거부한 바 있습니다. 그러나 EMA 산하 약물사용자문위원회(CHMP)는 보다 철저한 평가 후 결정을 번복했습니다.
새로운 권장 사항에 따라 Leqembi는 알츠하이머병의 중요한 위험 요소인 ApoE4 유전자를 보유한 초기 단계의 알츠하이머병 환자에게만 처방됩니다.
연구 결과, 이 환자 그룹에서는 Leqembi가 질병 진행을 늦추는 데 있어 이점이 위험보다 더 큰 것으로 나타났습니다.
유럽 연합 전역에서 레켐비의 판매 허가 여부에 대한 최종 결정은 유럽 집행위원회에서 내릴 것입니다. 승인이 완료되면 각 회원국은 해당 의약품의 가격과 건강 보험 적용 범위를 자체적으로 결정할 것입니다.
레켐비는 에자이(일본)와 바이오젠(미국)이라는 두 주요 제약 회사가 개발 및 제조하는 제품입니다. 이 약물은 알츠하이머 환자의 뇌에 축적되는 독성 단백질인 베타 아밀로이드 플라크를 제거하는 방식으로 작용합니다.
(베트남+)
[광고_2]
출처: https://www.vietnamplus.vn/eu-bat-den-xanh-cho-viec-su-dung-thuoc-leqembi-dieu-tri-alzheimer-post993619.vnp

































































































댓글 (0)