ໃນຊຸມປີມໍ່ໆມານີ້, ການປ່ຽນແປງທີ່ສໍາຄັນໃນຄວາມເຂົ້າໃຈຂອງພວກເຮົາກ່ຽວກັບມະເຮັງແມ່ນການຮັບຮູ້ວ່າຈຸລິນຊີບໍ່ພຽງແຕ່ຢູ່ໃນລໍາໄສ້, ແຕ່ຍັງຢູ່ໃນເນື້ອງອກ - ລວມທັງເນື້ອງອກແຂງເຊັ່ນເຕົ້ານົມ, ຕ່ອມລູກຫມາກ, ແລະປອດ. ຊຸມຊົນຈຸລິນຊີເຫຼົ່ານີ້ (ລວມກັນເອີ້ນວ່າ microbiome intratumoral ຫຼື microbiome ທີ່ກ່ຽວຂ້ອງກັບ tumor) ພົວພັນໂດຍກົງກັບຈຸລັງມະເຮັງ, ຈຸລັງພູມຕ້ານທານ, ແລະສະພາບແວດລ້ອມອ້ອມຂ້າງ, ດັ່ງນັ້ນມີອິດທິພົນຕໍ່ຊີວະວິທະຍາ tumor, ການຕອບສະຫນອງການປິ່ນປົວ, ແລະການຄາດຄະເນ.
microbiota ໃນເນື້ອເຍື່ອ tumor ແຕກຕ່າງຈາກ microbiota ໃນລໍາໄສ້ບໍ?
ເນື້ອເຍື່ອເນື້ອງອກໃນເມື່ອກ່ອນແມ່ນຄິດວ່າເປັນ "ເຂດທີ່ບໍ່ເປັນຫມັນ," ແຕ່ການວິເຄາະທາງພັນທຸກໍາແລະການຈັດລໍາດັບທີ່ຜ່ານມາໄດ້ເປີດເຜີຍ DNA / RNA ຈຸລິນຊີໃນຕົວຢ່າງເນື້ອງອກທີ່ຖືກປັບປຸງໃຫມ່. ຈຸລິນຊີເຫຼົ່ານີ້ອາດຈະອາໄສຢູ່ໃນຈຸລັງມະເຮັງ, ພາຍໃນຈຸລັງພູມຕ້ານທານ, ຫຼືຝັງຢູ່ໃນເນື້ອເຍື່ອເຊື່ອມຕໍ່ອ້ອມຂ້າງ. ອົງປະກອບແລະຄວາມຫນາແຫນ້ນຂອງຈຸລິນຊີແຕກຕ່າງກັນລະຫວ່າງປະເພດເນື້ອງອກແລະຄົນເຈັບ - ຕົວຢ່າງ, ເນື້ອງອກເຕົ້ານົມມີຄວາມຫຼາກຫຼາຍຂອງຈຸລິນຊີຂ້ອນຂ້າງສູງເມື່ອທຽບກັບເນື້ອງອກອື່ນໆ - ແລະສະຖານທີ່ຂອງພວກເຂົາ (intracellular vs extracellular) ກໍານົດວິທີການທີ່ພວກມັນມີຜົນກະທົບຕໍ່ເນື້ອເຍື່ອທີ່ເປັນພະຍາດ.
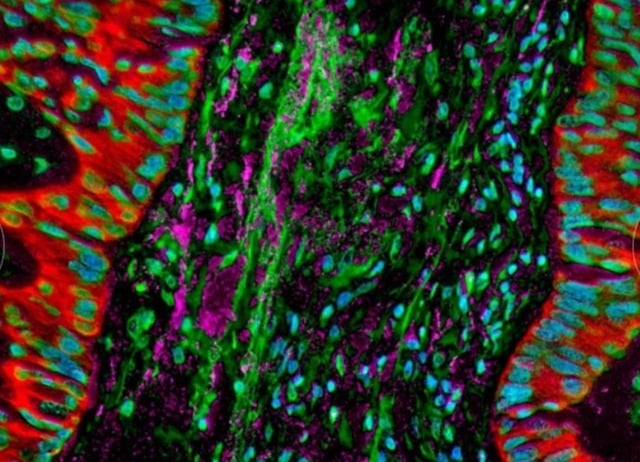
ຮູບພາບກ້ອງຈຸລະທັດສະແດງໃຫ້ເຫັນເຊື້ອແບັກທີເຣັຍທີ່ອາໄສຢູ່ໃນຈຸລັງມະເຮັງປອດ, ປ່ຽນແປງການຕອບສະຫນອງຂອງພູມຕ້ານທານຂອງຮ່າງກາຍ.
ພາລະບົດບາດຂອງເຊື້ອແບັກທີເຣັຍແລະໄວຣັສໃນເຕົ້ານົມ, prostate, ແລະເນື້ອເຍື່ອປອດ
microbiota ທ້ອງຖິ່ນສາມາດດັດແປງສະພາບແວດລ້ອມຂອງພູມຕ້ານທານໃນວິທີການສະກັດກັ້ນຫຼືການກະຕຸ້ນ. ບາງຈຸລິນຊີກະຕຸ້ນສັນຍານອັກເສບຊໍາເຮື້ອ (ເຊັ່ນ: ຜ່ານຕົວຮັບການຮັບຮູ້ແບບຈໍາລອງເຊັ່ນ TLRs), ນໍາໄປສູ່ການເພີ່ມຂື້ນຂອງ cytokines ອັກເສບ, ເຊິ່ງດຶງດູດຈຸລັງພູມຕ້ານທານທີ່ສະກັດກັ້ນ (M2 macrophages, Tregs) - ດ້ວຍເຫດນີ້ຈະຊ່ວຍໃຫ້ເນື້ອງອກຫລີກລ້ຽງພູມຕ້ານທານ. ໃນທາງກົງກັນຂ້າມ, ບາງເຊື້ອແບັກທີເຣັຍຫຼືໄວຣັສສາມາດກະຕຸ້ນພູມຕ້ານທານຂອງເຊນ (ການນໍາສະເຫນີ antigen ເພີ່ມຂຶ້ນ, ການກະຕຸ້ນຂອງ CD8+ T cell) ແລະປະກອບສ່ວນເຂົ້າໃນປະສິດທິພາບຂອງການປິ່ນປົວດ້ວຍພູມຕ້ານທານ. ດັ່ງນັ້ນ, microbiota ດຽວກັນສາມາດເປັນ "ເພື່ອນ" ຫຼື "ສັດຕູ" ຂຶ້ນກັບສະພາບການ.
ເຊື້ອແບັກທີເຣັຍບາງຊະນິດຜະລິດສານພິດຫຼືສານປະກອບທີ່ທໍາລາຍ DNA, ເຮັດໃຫ້ເກີດການກາຍພັນແລະສົ່ງເສີມການກ້າວຫນ້າຂອງມະເຮັງ. ໃນທາງກົງກັນຂ້າມ, ຈຸລິນຊີອື່ນໆສາມາດກະຕຸ້ນການເຜົາຜະຫລານອາຫານທີ່ຊ່ວຍຫຼຸດຜ່ອນການຂະຫຍາຍຕົວຂອງຈຸລັງ tumor. ໃນເນື້ອເຍື່ອເຕົ້ານົມ, ການສຶກສາໄດ້ບັນທຶກການປະກົດຕົວຂອງເຊື້ອແບັກທີເຣັຍທີ່ກ່ຽວຂ້ອງກັບເສັ້ນທາງການອັກເສບແລະການເຜົາຜະຫລານອາຫານ; ໃນ prostate, ການປ່ຽນແປງຂອງຈຸລິນຊີແມ່ນກ່ຽວຂ້ອງກັບຄວາມຄືບຫນ້າຂອງພະຍາດແລະການຕອບສະຫນອງຕໍ່ການປິ່ນປົວດ້ວຍຢາຕ້ານເຊື້ອ androgen; ແລະໃນປອດ, microbiome endogenous ອາດຈະພົວພັນກັບການອັກເສບທີ່ເຮັດໃຫ້ເກີດການສູບຢາແລະດັດແປງ microenvironment ເພື່ອເຮັດໃຫ້ tumors ຫນ້ອຍຕອບສະຫນອງຕໍ່ການປິ່ນປົວດ້ວຍພູມຕ້ານທານ.
ການປະກົດຕົວຫຼືອົງປະກອບຂອງ microbiome intratumoral ສາມາດປ່ຽນແປງປະສິດທິພາບຂອງການປິ່ນປົວດ້ວຍທາງເຄມີ, ການປິ່ນປົວດ້ວຍລັງສີ, ແລະໂດຍສະເພາະແມ່ນການປິ່ນປົວດ້ວຍພູມຕ້ານທານ. ກົນໄກປະກອບມີການປ່ຽນແປງຂອງສະພາບແວດລ້ອມຈຸນລະພາກ (pH, ໂພຊະນາການ), ການກະຕຸ້ນຢາໃນທ້ອງຖິ່ນ (ເຊື້ອແບັກທີເຣັຍບາງຊະນິດມີເອນໄຊທີ່ທໍາລາຍຢາ), ຫຼືການດັດແປງການນໍາສະເຫນີ antigen ແລະການແຊກຊຶມຂອງຈຸລັງພູມຕ້ານທານ. ການສຶກສາຈໍານວນຫນຶ່ງໄດ້ສະແດງໃຫ້ເຫັນວ່າຄວາມແຕກຕ່າງຂອງ microbiota tumor ແມ່ນກ່ຽວຂ້ອງກັບການຕອບສະຫນອງຫຼືຄວາມຕ້ານທານຕໍ່ຕົວຍັບຍັ້ງການກວດກາພູມຕ້ານທານ (ICIs).
ການດັດແປງ microbiome ທ້ອງຖິ່ນໃນເນື້ອເຍື່ອ tumor - ທີ່ມີຢູ່ແລ້ວແລະຍຸດທະສາດການສືບສວນ
ແນວຄວາມຄິດຂອງການແຊກແຊງໂດຍກົງກັບ microbiome tumor ແມ່ນການເປີດເສັ້ນທາງການປິ່ນປົວໃຫມ່. ບາງວິທີທີ່ໄດ້ຮັບຫຼືກໍາລັງພັດທະນາປະກອບມີ:
ໃນບາງແບບທົດລອງ, ການໃຊ້ຢາຕ້ານເຊື້ອເພື່ອກໍາຈັດຊະນິດທີ່ "ບໍ່ດີ" ໃນເນື້ອງອກໄດ້ປ່ຽນແປງການຕອບສະຫນອງຂອງເນື້ອເຍື່ອຕໍ່ຢາ. ຢ່າງໃດກໍ່ຕາມ, ຢາຕ້ານເຊື້ອທີ່ເປັນລະບົບມີຜົນກະທົບຢ່າງກວ້າງຂວາງ (ແລະອາດຈະລົບກວນ microbiome ລໍາໄສ້ທີ່ຈໍາເປັນສໍາລັບພູມຕ້ານທານ), ດັ່ງນັ້ນການນໍາໃຊ້ຢາຕ້ານເຊື້ອໃນທ້ອງຖິ່ນຫຼືການພັດທະນາຢາຕ້ານເຊື້ອທີ່ເລືອກສໍາລັບຊະນິດເປົ້າຫມາຍແມ່ນເປັນບູລິມະສິດ.
ແນວຄວາມຄິດແມ່ນເພື່ອແນະນໍາເຊື້ອແບັກທີເຣັຍທີ່ຖືກສ້າງຂື້ນເຂົ້າໄປໃນເນື້ອເຍື່ອເນື້ອງອກທີ່ secrete cytokines ກະຕຸ້ນພູມຕ້ານທານ, enzymes metabolic ທີ່ປ່ຽນແປງ pH, ຫຼື enzymes ທີ່ທໍາລາຍລະບົບພູມຕ້ານທານ. ການທົດລອງທາງດ້ານການຊ່ວຍບາງອັນໂດຍໃຊ້ເຊື້ອແບັກທີເຣັຍທີ່ອ່ອນແອເພື່ອສົ່ງຢາຢູ່ໃນທ້ອງຖິ່ນໄດ້ສະແດງໃຫ້ເຫັນຄໍາສັນຍາ.
ເຊື້ອໄວຣັສ Oncolytic ໄດ້ຖືກສຶກສາເພື່ອຂ້າຈຸລັງມະເຮັງໂດຍກົງແລະພ້ອມກັນກະຕຸ້ນພູມຕ້ານທານ antitumor. ການລວມເອົາໄວຣັສ oncolytic ກັບການດັດແກ້ microbiome ສາມາດເສີມຂະຫຍາຍການກະຕຸ້ນ T cell ທ້ອງຖິ່ນແລະຂະຫຍາຍການຕອບສະຫນອງລະບົບ.
ເຖິງແມ່ນວ່າຫົວຂໍ້ນີ້ແມ່ນຈຸລິນຊີທ້ອງຖິ່ນ, ມັນເປັນສິ່ງສໍາຄັນທີ່ຈະສັງເກດວ່າແກນ tumor ລໍາໄສ້ມີຢູ່: ການປ່ຽນແປງຂອງ microbiome ລໍາໄສ້ (ເຊັ່ນ: ໂດຍຜ່ານອາຫານ, probiotics, FMT) ສາມາດປ່ຽນແປງ microbiome intratumoral ແລະລະບົບພູມຕ້ານທານທາງອ້ອມ, ດັ່ງນັ້ນຜົນກະທົບຕໍ່ເນື້ອເຍື່ອ tumor ໃນປອດ, ເຕົ້ານົມ, ຫຼື prostate.

ນັກວິທະຍາສາດ ກໍາລັງວິເຄາະ DNA microbial ໃນເນື້ອເຍື່ອ tumor ເພື່ອຊອກຫາຊະນິດທີ່ມີອິດທິພົນຕໍ່ປະສິດທິພາບຂອງການປິ່ນປົວມະເຮັງ.
ສິ່ງທ້າທາຍທາງດ້ານຄລີນິກແລະການພິຈາລະນາ
- ຄວາມແຕກຕ່າງລະຫວ່າງ "ສາເຫດ" ແລະ "ຜົນກະທົບ": ການສຶກສາໃນປະຈຸບັນຈໍານວນຫຼາຍຍັງອະທິບາຍເຖິງຄວາມກ່ຽວຂ້ອງກັນແຕ່ຍັງບໍ່ໄດ້ຢືນຢັນຄວາມສໍາພັນທາງສາເຫດລະຫວ່າງຈຸລິນຊີແລະຄວາມຄືບຫນ້າຂອງເນື້ອງອກ.
- ການກໍານົດມາດຕະຖານດ້ານວິຊາການ: ການເກັບຕົວຢ່າງ, ການແຍກ DNA / RNA, ການຫຼີກເວັ້ນການປົນເປື້ອນ exogenous, ແລະການວິເຄາະ bioinformatics ທັງຫມົດຮຽກຮ້ອງໃຫ້ມີມາດຕະຖານສໍາລັບຜົນໄດ້ຮັບທີ່ເຊື່ອຖືໄດ້.
- ການປ່ຽນແປງສູງລະຫວ່າງຄົນເຈັບ: microbiome ແມ່ນຂຶ້ນກັບບຸກຄົນ; ການແຊກແຊງຈໍາເປັນຕ້ອງໄດ້ກໍານົດສ່ວນບຸກຄົນ.
- ຄວາມປອດໄພ: ການນໍາເຊື້ອແບັກທີເຣັຍຫຼືໄວຣັສທີ່ມີຊີວິດເຂົ້າໄປໃນເນື້ອເຍື່ອ tumor ມີຄວາມສ່ຽງຕໍ່ການຕິດເຊື້ອຫຼືພູມຕ້ານທານຫຼາຍເກີນໄປ; ການປິ່ນປົວເຫຼົ່ານີ້ຕ້ອງການການທົດສອບຢ່າງເຂັ້ມງວດ.
ການສຶກສາຂອງຈຸລິນຊີທີ່ກ່ຽວຂ້ອງກັບ tumor ເປີດຊັ້ນຊີວະສາດໃຫມ່ໃນ oncology: microbiome ທ້ອງຖິ່ນສາມາດເປັນທັງການສົ່ງເສີມການເປັນມະເຮັງແລະເຄື່ອງມືສໍາລັບການປັບຕົວຂອງພູມຕ້ານທານແລະການສົ່ງຢາເປົ້າຫມາຍໄປສູ່ເນື້ອງອກ. ດ້ວຍຄວາມກ້າວຫນ້າໃນການຈັດລໍາດັບ, histology, biomimicry, ແລະເຕັກນິກວິສະວະກໍາ microbiome, ໃນອະນາຄົດອັນໃກ້ນີ້ສັນຍາວ່າຍຸດທະສາດການປິ່ນປົວທີ່ເປົ້າຫມາຍຫຼືຂຸດຄົ້ນ microbiome ທ້ອງຖິ່ນ - ຈາກເຊື້ອແບັກທີເຣັຍ bioengineered, phages ການຄັດເລືອກ, ກັບ immunocompetent oncolytic viruses - ຈະກາຍເປັນສ່ວນຫນຶ່ງຂອງການປິ່ນປົວ multimodal.
ຢ່າງໃດກໍຕາມ, ເສັ້ນທາງທາງດ້ານການຊ່ວຍແມ່ນຍັງຍາວ; ມາດຕະຖານຂອງການທົດສອບ, ການສະແດງໃຫ້ເຫັນເຖິງສາເຫດ, ແລະການຮັບປະກັນຄວາມປອດໄພຈະເປັນເງື່ອນໄຂເບື້ອງຕົ້ນກ່ອນທີ່ການແຊກແຊງເຫຼົ່ານີ້ຈະຖືກຮັບຮອງເອົາຢ່າງກວ້າງຂວາງ.
ທີ່ມາ: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm






































































































(0)