Under senare år har en stor förändring i vår förståelse av cancer skett, med insikten att mikroorganismer inte bara finns i tarmen utan även i tumörvävnad – inklusive solida tumörer som bröst, prostata och lunga. Dessa mikrobiella samhällen (gemensamt kallade det intratumorala mikrobiomet eller tumörassocierat mikrobiom) interagerar direkt med cancerceller, immunceller och den omgivande miljön, vilket påverkar tumörbiologi, behandlingssvar och prognos.
Skiljer sig mikrobiotan i tumörvävnad från tarmmikrobiotan?
Tumörvävnad ansågs tidigare vara en "steril zon", men nyligen genomförd genomisk analys och sekvenseringsanalys har avslöjat mikrobiellt DNA/RNA i många resekerade tumörprover. Dessa mikrober kan finnas i cancerceller, i immunceller eller inbäddade i den omgivande bindväven. Mikrobernas sammansättning och densitet varierar mellan tumörtyper och patienter – till exempel har brösttumörer relativt hög mikrobiell mångfald jämfört med vissa andra tumörer – och deras placering (intracellulär vs. extracellulär) avgör hur de påverkar sjuk vävnad.
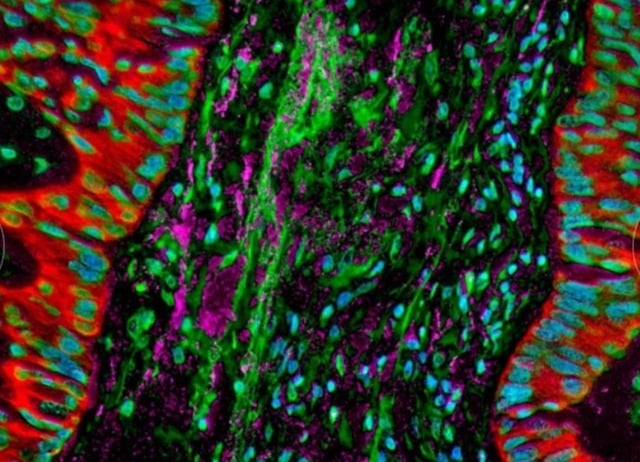
Mikroskopiska bilder visar bakterier som finns i lungcancerceller och förändrar kroppens immunsvar.
Bakteriers och virus roll i bröst-, prostata- och lungvävnad
Lokal mikrobiota kan modulera immunmiljön antingen på ett hämmande eller aktiverande sätt. Vissa mikrober utlöser kroniska inflammatoriska signaler (t.ex. via mönsterigenkänningsreceptorer som TLR), vilket leder till ökade proinflammatoriska cytokiner, vilka attraherar hämmande immunceller (M2-makrofager, Tregs) – och därigenom hjälper tumörer att undvika immunitet. Omvänt kan vissa bakterier eller virus stimulera cellulär immunitet (ökad antigenpresentation, CD8+ T-cellsaktivering) och bidra till immunterapins effektivitet. Således kan samma mikrobiota vara en "vän" eller "fiende" beroende på sammanhanget.
Vissa bakterier producerar toxiner eller föreningar som skadar DNA, vilket orsakar mutationer och främjar cancerprogression. Omvänt kan andra mikrober inducera metabolism som minskar tumörcellstillväxt. I bröstvävnad har studier dokumenterat förekomsten av bakterier involverade i inflammatoriska och metaboliska vägar; i prostata är mikrobiella förändringar associerade med sjukdomsprogression och respons på antiandrogenbehandling; och i lungan kan det endogena mikrobiomet interagera med rökningsinducerad inflammation och modifiera mikromiljön för att göra tumörer mindre mottagliga för immunterapi.
Närvaron eller sammansättningen av det intratumorala mikrobiomet kan förändra effekten av kemoterapi, strålbehandling och särskilt immunterapi. Mekanismer inkluderar förändringar i mikromiljön (pH, näring), lokal läkemedelsinaktivering (vissa bakterier har läkemedelsnedbrytande enzymer) eller modulering av antigenpresentation och immuncellsinfiltration. Flera studier har visat att skillnader i tumörmikrobiota är associerade med respons eller resistens mot immunkontrollpunktshämmare (ICI).
Lokal mikrobiommodifiering i tumörvävnad – befintliga och prövningsstrategier
Idén att direkt störa tumörmikrobiomet öppnar upp nya behandlingsmöjligheter. Några av de metoder som har utvecklats eller håller på att utvecklas inkluderar:
I vissa experimentella modeller har användning av antibiotika för att eliminera "dåliga" arter i tumörer förändrat vävnadsreaktioner på läkemedlen. Systemiska antibiotika har dock utbredda effekter (och kan störa tarmmikrobiomet som är nödvändigt för immunitet), så lokal antibiotikaanvändning eller utveckling av antibiotika som är selektiva för målarter är en prioritet.
Tanken är att introducera modifierade bakterier i tumörvävnad som utsöndrar immunstimulerande cytokiner, metaboliska enzymer som förändrar pH-värdet eller enzymer som bryter ner immunsuppressiva medel. Vissa prekliniska prövningar med försvagade bakterier för att administrera läkemedel lokalt har visat lovande resultat.
Onkolytiska virus har studerats för att direkt döda cancerceller och samtidigt stimulera antitumörimmunitet. Att kombinera onkolytiska virus med mikrobiomredigering kan förbättra lokal T-cellsaktivering och expandera systemiska svar.
Även om ämnet här är lokal mikrobiologi är det viktigt att notera att det finns en tarm-tumöraxel: förändringar i tarmmikrobiomet (t.ex. genom kost, probiotika, FMT) kan indirekt förändra det intratumorala mikrobiomet och den systemiska immuniteten, och därigenom påverka tumörvävnad i lunga, bröst eller prostata.

Forskare analyserar mikrobiellt DNA i tumörvävnad för att hitta arter som påverkar effektiviteten av cancerbehandling.
Kliniska utmaningar och överväganden
- Att skilja mellan "orsak" och "verkan": många aktuella studier beskriver fortfarande korrelationer men har inte bekräftat ett orsakssamband mellan mikrobiologi och tumörprogression.
- Teknisk standardisering: provtagning, DNA/RNA-isolering, undvikande av exogen kontaminering och bioinformatisk analys kräver alla standardisering för tillförlitliga resultat.
- Hög variation mellan patienter: mikrobiomet är individberoende; interventioner måste individualiseras.
- Säkerhet: Att introducera levande bakterier eller virus i tumörvävnad medför en risk för infektion eller immunöverreaktion; dessa behandlingar kräver rigorösa tester.
Studien av det tumörassocierade mikrobiomet öppnar ett nytt lager av biologin inom onkologi: det lokala mikrobiomet kan vara både en cancerpromotor och ett verktyg för immunmodulering och riktad läkemedelsleverans till tumörer. Med framsteg inom sekvensering, histologi, biomimik och mikrobiomtekniker lovar den närmaste framtiden att terapeutiska strategier som riktar sig mot eller utnyttjar det lokala mikrobiomet – från biomanipulerade bakterier, selektiva fager till immunkompetenta onkolytiska virus – kommer att bli en del av multimodal terapi.
Den kliniska vägen är dock fortfarande lång; standardisering av tester, påvisning av kausalitet och säkerställande av säkerhet kommer att vara förutsättningar innan dessa interventioner antas i stor utsträckning.
Källa: https://suckhoedoisong.vn/lieu-co-the-chua-ung-thu-bang-cach-dieu-chinh-vi-sinh-trong-mo-u-169251028135655078.htm



























































































![Övergången till Dong Nai OCOP: [Artikel 3] Koppla samman turism med konsumtion av OCOP-produkter](https://vphoto.vietnam.vn/thumb/402x226/vietnam/resource/IMAGE/2025/11/10/1762739199309_1324-2740-7_n-162543_981.jpeg)












Kommentar (0)