
Ця децентралізація реалізується відповідно до положень нових Указів, виданих у 2025 році, таких як: Указ № 163/2025/ND-CP (щодо впровадження Закону про фармацевтичну діяльність), Указ № 217/2025/ND-CP (щодо спеціалізованої інспекції), Указ № 42/2025/ND-CP (щодо організації Міністерства охорони здоров'я ) та інші відповідні нормативні акти.
Згідно з Циркуляром, Департаменту з контролю за лікарськими засобами надано повноваження щодо комплексного виконання 32 адміністративних процедур, пов'язаних з ліцензуванням імпорту та експорту лікарських засобів та їх інгредієнтів, включаючи лікарські засоби, що підлягають спеціальному контролю, такі як: наркотичні речовини, психотропні речовини, прекурсори, радіоактивні речовини, допоміжні речовини тощо; оцінки та подання на видачу всіх видів сертифікатів про право на фармацевтичну діяльність, сертифікатів на фармацевтичну практику у формі іспитів; ліцензування змісту реклами лікарських засобів, здійснення коригування та виправлення змісту; управління цінами на лікарські засоби, включаючи публікацію, повторну публікацію та рекомендації оптових цін на рецептурні препарати.
Крім того, Департамент також відповідає за оцінку записів клінічних випробувань, наукові дослідження, тестування ліків, закупівлю та продаж спеціальної сировини... Примітно, що багато процедур, які раніше вимагали консультацій на рівні Міністерства, тепер безпосередньо отримуються, обробляються та вирішуються Департаментом з управління лікарськими засобами, що сприяє скороченню часу обробки, а також підвищує ініціативу професійних установ.
Паралельно з впровадженням нової процедури, Департаменту з управління лікарськими засобами доручено продовжувати обробку адміністративних процедур, поданих до 1 липня 2025 року, відповідно до старих правил, викладених у Декреті 54/2017/ND-CP, Декреті 155/2018/ND-CP та Декреті 88/2023/ND-CP.
Джерело: https://baohaiphong.vn/bo-y-te-phan-cap-chi-tiet-mot-so-thu-tuc-hanh-chinh-linh-vuc-duoc-521844.html







![[Фото] Міст Бінь Трієу 1 завершено, його підняли на 1,1 м, і його відкриють для руху наприкінці листопада.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/10/2/a6549e2a3b5848a1ba76a1ded6141fae)



























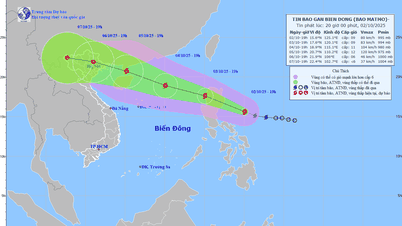

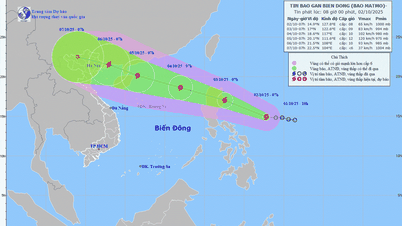





































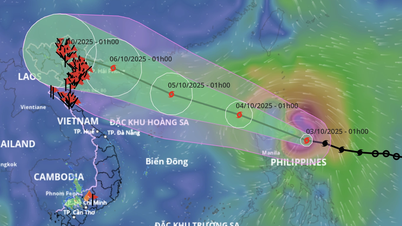






























Коментар (0)