في جلسة بعد الظهر يوم 21 نوفمبر، الدورة الثامنة للجمعية الوطنية الخامسة عشرة، وبموافقة أغلبية النواب، أقر مجلس النواب رسميا القانون المعدل والمكمل لعدد من مواد قانون الصيدلة.

بأغلبية 88.94% من أصوات النواب، تم التصديق رسميا على قانون تعديل وتكملة عدد من مواد قانون الصيدلة في الدورة الثامنة للجمعية الوطنية الخامسة عشرة.
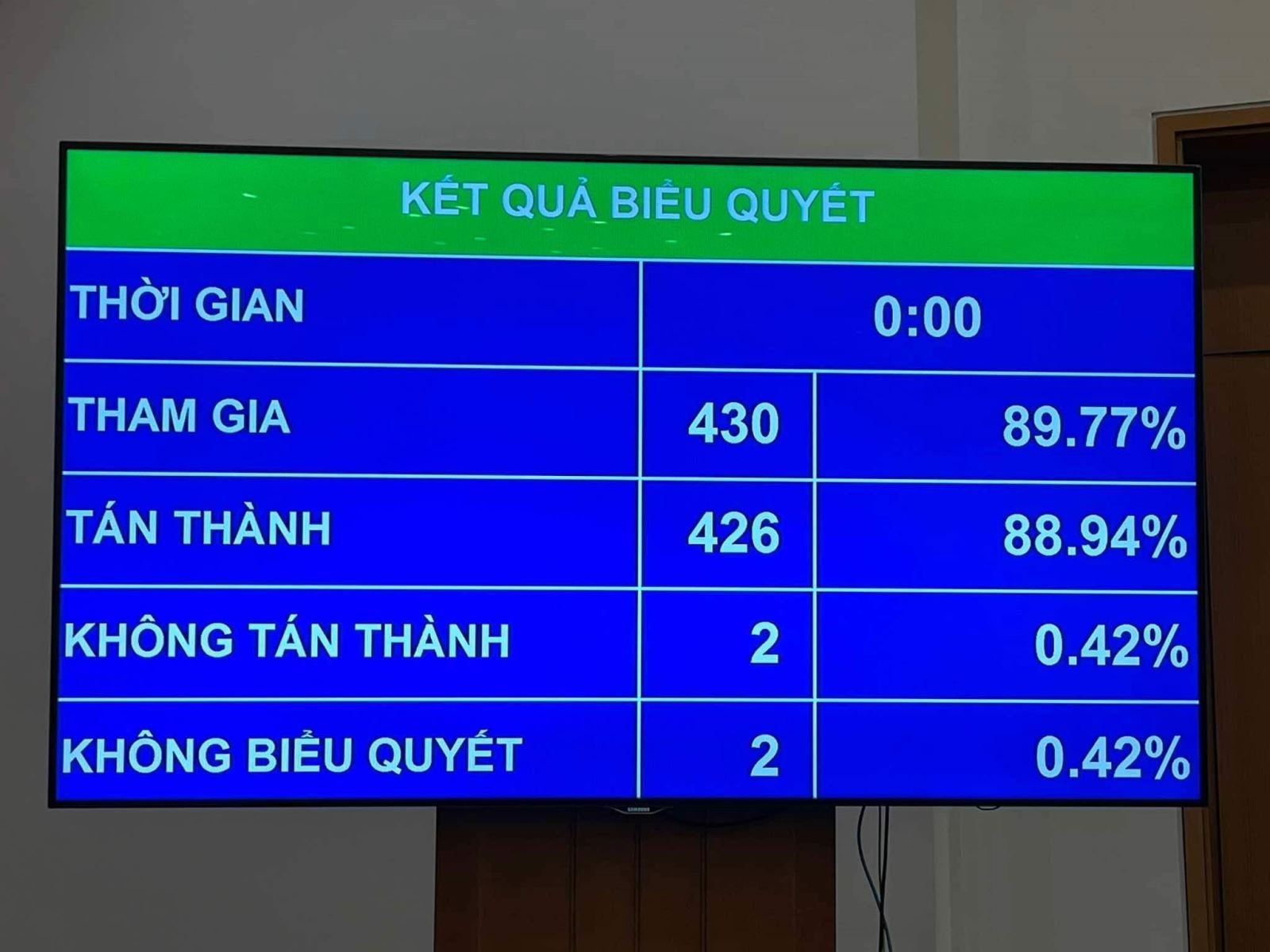
قبل أن يصوت نواب مجلس الأمة على الموافقة على مشروع القانون كاملاً المعدل والمكمل لعدد من مواد قانون الصيدلة، صوت مجلس الأمة على الموافقة على مادتين من القانون هما:
بشأن المادة 23 من المادة الأولى بشأن حقوق ومسؤوليات المؤسسات المنظمة لسلاسل الصيدليات والصيدليات في سلسلة الصيدليات. وكانت نتيجة التصويت 89.14% من أصوات المندوبين لصالح ذلك.
التصويت على المادة 30 من المادة الأولى بشأن الصلاحيات والسجلات والإجراءات والوقت لمنح وتجديد شهادات التسجيل لتداول الأدوية والمكونات الصيدلانية. وكانت نتيجة التصويت 86.22% من أصوات المندوبين لصالح ذلك.
قبل التصويت، قرأت السيدة نجوين ثوي آنه، رئيسة اللجنة الاجتماعية بالجمعية الوطنية، التقرير المتعلق باستلام وشرح ومراجعة مشروع القانون الذي يعدل ويكمل عدداً من مواد قانون الصيدلة.
فيما يتعلق تحديدًا بسياسة الدولة بشأن الأدوية وتطوير صناعة الأدوية (المادتان 7 و8 (المعدلتان)، ومع مراعاة آراء النواب، وجهت اللجنة الدائمة للجمعية الوطنية مراجعة المادة 7 (المعدلة) لضمان عكسها للمحتوى الرئيسي للمبادئ؛ بإضافة الأحكام التالية في البند 14: "توجد سياسة للتحكم في عدد شهادات تسجيل تداول الأدوية التي تحتوي على نفس المكونات الفعالة والمواد الطبية وفقًا للظروف الاجتماعية والاقتصادية في كل فترة" و"إعطاء الأولوية للاستثمار في تطوير البنية التحتية لتكنولوجيا المعلومات، وتطبيق التحول الرقمي في الأنشطة الدوائية" في البند 15. ومع ذلك، لكي تدخل هذه السياسة حيز التنفيذ، وخاصة الأحكام الواردة في البنود 8 و13 و14، تود اللجنة الدائمة للجمعية الوطنية طلب الإذن لتكليف الحكومة بتحديد هذه المادة بالتفصيل.
وفيما يتعلق بالسياسات التفضيلية ودعم الاستثمار في التنمية الصناعية، وبناء على آراء أغلبية النواب، وافقت اللجنة الدائمة للجمعية الوطنية مع الحكومة على اعتماد البند 1، المادة 8 وفقا للخيار 1، والذي يسمح بتطبيق حوافز خاصة ودعم استثماري للمشاريع التي تم إنشاؤها حديثًا في قطاع الأدوية برأس مال استثماري إجمالي يبلغ 3000 مليار دونج أو أكثر، وصرف ما لا يقل عن 1000 مليار دونج في غضون 3 سنوات من تاريخ منح شهادة تسجيل الاستثمار أو الموافقة على سياسة الاستثمار. وفي الوقت نفسه، ولضمان الاتساق في السياسات التفضيلية ودعم الاستثمار الخاص في قطاع الأدوية، طلبت اللجنة الدائمة للجمعية الوطنية من الحكومة توجيه الاهتمام للتعبير عن الحوافز الضريبية عند تعديل قوانين الضرائب والقوانين ذات الصلة، بما في ذلك مشروع قانون ضريبة دخل الشركات (المعدل).
فيما يتعلق بأعمال سلسلة الصيدليات (المادة 17أ (مُكملة)؛ المواد 31، 32، 33، 36، 37 و38 (معدلة)؛ المادة 47أ (مُكملة)؛ بناءً على آراء المندوبين، راجعت اللجنة الدائمة للجمعية الوطنية ونقحت الأحكام المتعلقة بسلاسل الصيدليات؛ بما في ذلك محتوى تكليف وزير الصحة بتنظيم دوران الأشخاص المسؤولين عن الخبرة الصيدلانية بين الصيدليات في السلسلة كما هو موضح في النقطة ز، البند 2، المادة 47أ (مُكملة)؛ وتنظيم مسؤولية الصيدليات في السلسلة عن تعليق العمليات مؤقتًا في حالة تعليق منشأة منظمة سلسلة الصيدليات لعملياتها مؤقتًا لمدة 6 أشهر أو أكثر (النقطة د، البند 4، المادة 47أ (مُكملة)، وإنهاء العمليات عندما تتوقف منشأة منظمة سلسلة الصيدليات عن عملياتها (النقطة د، البند 4، المادة 47أ (مُكملة).
بشأن تداول الأدوية والمكونات الصيدلانية عن طريق التجارة الإلكترونية (المواد 6 و32 و42 (المعدلة))؛ وبناء على آراء النواب، ولضمان الإدارة السريعة للمواقف التي قد تنشأ في الممارسة العملية، بالإضافة إلى الحقوق والمسؤوليات المنصوص عليها في مشروع القانون، أضافت اللجنة الدائمة للجمعية الوطنية بندًا ينص على أن مؤسسات الأعمال الصيدلانية التي تستخدم أساليب التجارة الإلكترونية يجب أن تمتثل للوائح الحكومة بشأن الجملة للأدوية والمكونات الصيدلانية وتجارة التجزئة للأدوية باستخدام أساليب التجارة الإلكترونية في النقطة (ح)، البند 4، المادة 42 (المعدلة). وفي الوقت نفسه، تلخيص اللوائح المتعلقة بحقوق ومسؤوليات مؤسسات الأعمال الصيدلانية عند ممارسة الأعمال التجارية عن طريق طريقة التجارة الإلكترونية في الفقرة 4، المادة 42 (المعدلة).
فيما يتعلق بإصدار وتمديد وتغيير واستكمال شهادات تسجيل تداول الأدوية (المادة 56 (المعدلة)؛ وتطبيقًا لمبدأ التفكير الإبداعي في البناء التشريعي، قامت اللجنة الدائمة للجمعية الوطنية بمراجعة المحتوى المعدل في المادة 56 في اتجاه عدم التنظيم على وجه التحديد في القانون ولكن تكليف وزير الصحة بتحديد الملفات والإجراءات الخاصة بإصدار وتمديد وتغيير واستكمال شهادات تسجيل تداول الأدوية والمكونات الصيدلانية في المادة 56.
بالإضافة إلى ذلك، وقبول آراء المندوبين الذين يقترحون دراسة واستكمال اللوائح للحد من إصدار شهادات تسجيل تداول جديدة للأدوية المتداخلة، والحد من استغلال السياسات "لحجز" التسجيل لرخص التداول بسبب انخفاض رسوم الترخيص، في المستقبل القريب، تنص المادة 7، المادة 56 (المعدلة) على أنه لن يتم تمديد شهادة تسجيل التداول للأدوية التي لم يتم تداولها في السوق لمدة 5 سنوات. وفي الوقت نفسه، تنص المادة 14، المادة 7 (المعدلة) على أن الدولة لديها سياسة للسيطرة على عدد شهادات تسجيل تداول الأدوية للأدوية التي تحتوي على نفس المادة الفعالة والأعشاب الطبية، وتكلف الحكومة بتوفير لوائح مفصلة.
فيما يتعلق بإدارة أسعار الأدوية (شرح المصطلحات الواردة في البنود 44 و45 و46 و47، المادة 2 (المعدلة)؛ المواد 107 و109 و110 و112 و113 (المعدلة)؛ إلغاء المادة 114): بعد أخذ آراء النواب في الاعتبار، راجعت اللجنة الدائمة للجمعية الوطنية ووافقت على اقتراح الحكومة بشأن تنظيم التدابير الخاصة بإعلان أسعار الجملة المتوقع تطبيقها على الأدوية الموصوفة. وهذا إجراء محدد في إدارة أسعار الأدوية لأن الأدوية الموصوفة طبياً تشكل نسبة كبيرة من السوق، وتستخدم على نطاق واسع في المرافق الطبية ويجب على المرضى شراؤها وفقاً لوصفة الطبيب. كما توصي وزارة الصحة بتحديد سعر الجملة المتوقع للأدوية لشركات الأدوية للحد من ارتفاع أسعار الأدوية عبر كل مستوى ومستوى متوسط وزيادة الأسعار عند وصولها إلى المستهلكين. وفي الوقت نفسه، الحفاظ على اللوائح الحالية بشأن الحد الأقصى لهامش البيع بالتجزئة للأدوية التي تباع في مؤسسات بيع الأدوية بالتجزئة داخل مباني مرافق الفحص والعلاج الطبي.
وفيما يتعلق بمقترح النواب بشأن إجراءات إعلان الأسعار، وحيث أن هذا المحتوى يتم تنفيذه وفقاً لقانون الأسعار، اقترحت اللجنة الدائمة للجمعية الوطنية أن تقوم الحكومة بمراجعة الوثائق التوجيهية واللوائح التفصيلية لقانون الأسعار لعام 2023 لتكملة اللوائح الخاصة بمعايير اختيار قائمة المؤسسات المطلوبة لإعلان الأسعار، وضمان التنفيذ المتسق والشفاف في المحليات؛ وفي الوقت نفسه، مراقبة عملية التنفيذ عن كثب، والكشف الفوري عن الصعوبات والمشاكل التي يتعين معالجتها؛ يُطلب من وزارة الصحة تحديث قائمة الأدوية الأساسية بشكل دوري لضمان التوجيه الكامل وفقًا لأحكام قانون الأسعار.
فيما يتعلق بأحكام التنفيذ (المادة 3): استجابة لآراء النواب، قامت اللجنة الدائمة للجمعية الوطنية بمراجعة أثر التنفيذ والأحكام الانتقالية كما هو موضح في المادة 3 من مشروع القانون، وبناءً عليه، يدخل القانون حيز التنفيذ اعتبارًا من 1 يوليو 2025 (البند 1، المادة 3) وينطبق فقط اعتبارًا من 1 يناير 2025 على الأحكام المتعلقة بتمديد شهادة التسجيل لتداول الأدوية والمكونات الصيدلانية، والأحكام المتعلقة ببيع الأدوية والمكونات الصيدلانية بالجملة من قبل مؤسسات تصنيع الأدوية واستيرادها وتجارة الجملة (البند 2، المادة 3) للتغلب على الصعوبات في مجال الأدوية على الفور.
وقد تمت دراسة آراء نواب مجلس الأمة بشكل جدي واستيعابها بشكل كامل وتم تعديل مشروع القانون في محتويات محددة مثل: (أ) مفهومي "الأدوية التي لا تستلزم وصفة طبية" و"الأدوية عالية التقنية"؛ (ثانياً) أن ينص على أن الشخص المسؤول عن الخبرة الصيدلانية في منظمة سلسلة الصيدليات يجب أن يكون حاصلاً على درجة صيدلي وأن يكون لديه 02 سنة من الممارسة المهنية في منشأة صيدلانية مناسبة؛ (ثالثا) ضمان الشفافية والاتساق في اللوائح المتعلقة بحقوق مؤسسات التصنيع ومؤسسات التصدير والاستيراد ومؤسسات البيع بالجملة للأدوية والمكونات الصيدلانية والشركات الصيدلانية ذات الاستثمارات الأجنبية؛ (iv) السماح لمرافق الفحص والعلاج الطبي باستيراد الأدوية التي لا تحتوي على شهادة تسجيل تداول في فيتنام لتلبية احتياجات العلاج الخاصة لمرضى المنشأة في النقطة i، البند 2، المادة 60 وتكليف الحكومة بتحديد تفاصيل نقل الأدوية في النقطة d، البند 7، المادة 60؛ (v) تكليف وزير الصحة بتحديد شكل وطريقة نشر المعلومات الدوائية (بدلاً من الحكومة كما هو الحال حالياً) ومراجعة الصياغة والأسلوب والأساليب التشريعية في معظم مواد وبنود مشروع القانون.
يتكون مشروع القانون المعدل من 3 مواد، المادة الأولى منها تعدل 50 مادة، وتلغي نقطتين وبندين ومادة واحدة من قانون الصيدلة الحالي، وتضيف 3 مواد جديدة؛ المادة 2 تعدل وتكمل الملحق رقم 01 الصادر مع قانون الأسعار رقم 16/2023/QH15؛ المادة 3 بشأن شروط التنفيذ.
تم عرض محتويات الاستقبال والشرح والتعديل على وجه التحديد في التقرير رقم 1062 مع 06 محتويات رئيسية و 10 محتويات محددة ومحتويات أخرى.
وبالمقارنة مع القانون الحالي، فإن مشروع القانون يحتوي على 7 مجموعات أساسية جديدة من النقاط على النحو التالي:
وتستمر سياسة الدولة في مجال الأدوية في التطور، وترسيخ وجهات نظر الحزب بهدف تطوير صناعة الأدوية الفيتنامية لتصبح صناعة رائدة. وعليه، يضيف مشروع القانون عدداً من الأحكام الأكثر ابتكاراً مقارنة بقانون الصيدلة لعام 2016 لجذب الاستثمار وتعزيز البحث والتطوير في مجال إنتاج الأدوية والمكونات الصيدلانية، مثل السياسات التفضيلية بشأن الإجراءات الإدارية عند منح شهادات تسجيل التداول ورخص الاستيراد؛ السياسات الرامية إلى تطبيق الآليات التفضيلية والدعم من صناديق الدعم للأنشطة العلمية والتكنولوجية في مجال البحث والتطوير والتجارب السريرية ونقل التكنولوجيا وإنتاج الأدوية والمكونات الصيدلانية؛ - سياسات تثبيت وخفض الأسعار لبعض مجموعات الأدوية مع نقل تكنولوجيا الإنتاج؛ سياسة التحول الرقمي في الأنشطة الصيدلانية؛ تحديد حجم المشاريع في قطاع الأدوية المؤهلة للحصول على الحوافز والدعم الاستثماري الخاص، وتكليف الحكومة بوضع لوائح مفصلة لضمان جدواها وتجسيد سياسات الدولة في مجال الأدوية وتطوير الصناعة الدوائية.
إنشاء ممر قانوني لأشكال وأساليب العمل الجديدة، وهي: (أ) تنظيم إنشاء سلسلة الصيدليات كنوع منفصل من مؤسسات الأعمال الصيدلانية، وشروط العمل، وحقوق ومسؤوليات إنشاء سلسلة الصيدليات، والصيدليات في سلسلة الصيدليات، ولا سيما الحق في تدوير الأدوية والحق في تدوير الأشخاص المسؤولين عن الخبرة الصيدلانية بين الصيدليات في سلسلة الصيدليات؛ (ثانياً) اللوائح المتعلقة بتداول الأدوية والمكونات الصيدلانية عن طريق التجارة الإلكترونية، وبشكل خاص، استكمال اللوائح المتعلقة بالوسائل الإلكترونية وأنواع الأدوية والمكونات الصيدلانية المسموح بتداولها عن طريق التجارة الإلكترونية؛ استكمال حقوق ومسؤوليات المؤسسات التجارية الصيدلانية وفق هذه الطريقة.
تحديد حقوق ومسؤوليات شركات الأدوية ذات الاستثمار الأجنبي في القانون لضمان الدعاية والشفافية في إدارة الدولة.
- توسيع حقوق مؤسسات التصنيع ومؤسسات التصدير والاستيراد ومؤسسات البيع بالجملة للأدوية والمكونات الصيدلانية في البيع مباشرة لعدد من المرافق الطبية ومرافق إعادة تأهيل المخدرات ومرافق الاختبار ومرافق البحث والتدريب وعدد من المرافق الأخرى؛ السماح لمراكز الفحص والعلاج الطبي باستيراد الأدوية لتلبية الاحتياجات العلاجية الخاصة للمرضى في مركز الفحص والعلاج الطبي.
تعزيز إصلاح الإجراءات الإدارية في تسجيل تداول الأدوية والمكونات الصيدلانية في اتجاه تصنيف الأدوية والمكونات الصيدلانية على أساس مستويات مختلفة من خصائص الدواء وكذلك التداول لضبط السجلات والإجراءات والحدود الزمنية لمنح وتمديد وتغيير واستكمال شهادات تسجيل تداول الأدوية والمكونات الصيدلانية وفقًا لذلك لزيادة القدرة على الوصول إلى الأدوية في وقت مبكر للناس مع ضمان فعالية إدارة الدولة ومراقبة الجودة والسلامة وفعالية الأدوية؛ استكمال اللوائح الخاصة بالحد من إصدار أرقام تسجيل التداول المكررة. وفي الوقت نفسه، هناك لوائح محددة بشأن السجلات والإجراءات الخاصة بتسجيل الأدوية ومكوناتها واختبارها والاتجار بها بشكل عام لتلبية متطلبات الدفاع الوطني والأمن والكوارث الطبيعية والأزمات والأوبئة.
إلغاء إجراء التأكد من محتوى المعلومات الدوائية. تعزيز اللامركزية وتفويض الصلاحيات وتعزيز دور وزارة الصحة في استدعاء الأدوية المخالفة للجودة في مجال الإدارة ومعالجتها على الفور وضمان الاستخدام الآمن والفعال للأدوية.
تحديد تدابير إدارة الأسعار للامتثال لقانون الأسعار والتدابير المحددة في إدارة أسعار الأدوية هي الإعلان وإعادة الإعلان عن أسعار الجملة المتوقعة المطبقة على الأدوية الموصوفة، والتأكد من أن بيع الأدوية بالجملة من خلال مستويات الوساطة لا يتجاوز أسعار الجملة المتوقعة المعلنة.
في إن إيه
[إعلان 2]
المصدر: https://baohanam.com.vn/chinh-tri/nguoi-dai-bieu-nhan-dan/quoc-hoi-chinh-thuc-thong-qua-luat-duoc-sua-doi-140545.html





![[صورة] رئيس الوزراء فام مينه تشينه يرأس اجتماعا بشأن تنفيذ مشروع خط السكة الحديد لاو كاي-هانوي-هايفونج.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/20/0fa4c9864f63456ebc0eb504c09c7e26)




















































































تعليق (0)