Neuralink, Elon Musks Unternehmen für Gehirnchipimplantate, gibt an, von der US-amerikanischen Food and Drug Administration (FDA) die Genehmigung für seine erste klinische Studie am Menschen erhalten zu haben.

Das 2016 gegründete Unternehmen Neuralink erklärte in einer Erklärung, dies sei der erste Schritt, der „es unserer Technologie eines Tages ermöglichen wird, vielen Menschen zu helfen“.
„Die Rekrutierung für unsere klinische Studie hat noch nicht begonnen“, fügte Musks Unternehmen auf Twitter hinzu und versprach, in den kommenden Tagen weitere Informationen zu erhalten.
Der Milliardär und Unternehmer Elon Musk sagte im vergangenen Dezember voraus, dass Neuralink in der ersten Hälfte dieses Jahres die behördliche Zulassung erhalten würde. Und er hatte Recht, obwohl der Genehmigungsprozess nicht einfach war und letztes Jahr abgelehnt wurde.
Neuralink weckt seit Jahren große Erwartungen an seine Produkte. 2020 behauptete Musk in einer Präsentation, die Chips des Unternehmens könnten Krankheiten wie Lähmungen und Schlaflosigkeit heilen. Er fügte hinzu, Neuralink-Chips könnten Nutzern sogar „übermenschliches“ Sehvermögen verleihen. Damals demonstrierte das Unternehmen seine ersten Gehirnchip-Implantate an Schweinen.

Im Jahr 2021 hielten Vertreter von Neuralink eine ihrer bisher viralsten Präsentationen. Ein Affe namens Pager saß vor einem Fernseher und verfolgte aufmerksam das Geschehen auf dem Bildschirm – ein Videospiel namens Pong. Der Primat steuerte seine Bewegungen allein mit den Augen, dank eines Halbleiterbauelements von der Größe eines Vierteldollarmünzen, das in beide Gehirnhälften implantiert war.
Elon Musk prahlte seit 2019 wiederholt damit, die FDA-Zulassung für klinische Studien am Menschen anzustreben. Doch Unternehmensvertreter werden sich erst 2022 bei der Behörde bewerben. Laut Reuters wurde Neuralinks erster Antrag kurz nach Einreichung von der FDA abgelehnt. Berichten zufolge äußerte die Behörde Bedenken hinsichtlich der Lithiumbatterie des Geräts, des Risikos, dass die Drähte des Implantats im Gehirn wandern, und der Herausforderung, das Gerät sicher zu entfernen, ohne das Hirngewebe zu schädigen.
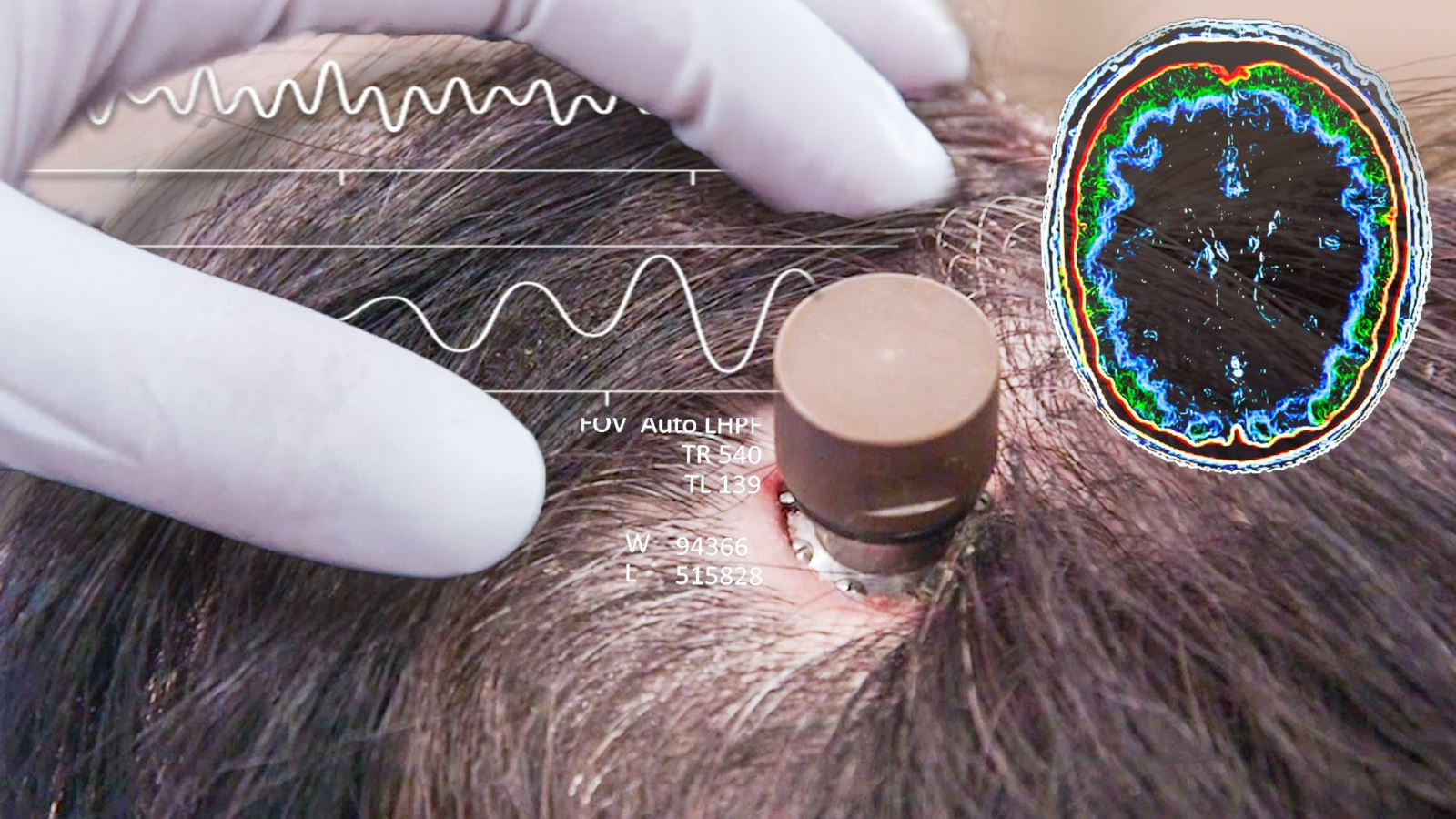
Laut einem Reuters-Sonderbericht vom März äußerten einige Neuralink-Mitarbeiter Zweifel daran, dass Neuralink die von der FDA angesprochenen Probleme schnell lösen könne. Kip Ludwig, ehemaliger Leiter des Neurotechnik-Programms der US-amerikanischen National Institutes of Health (NIH), sagte gegenüber Reuters: „Neuralink scheint nicht über die nötige Denkweise und Erfahrung zu verfügen, um dieses Produkt schnell auf den Markt zu bringen.“
Neuralink ist nicht das einzige Unternehmen, das klinische Studien mit Gehirnimplantaten am Menschen vorbereitet. Einer seiner Hauptkonkurrenten, Paradromics, strebt ebenfalls die Zulassung der FDA an.
Das 2015 gegründete Neurotech-Startup aus Austin, Texas, hat mit seinem implantierbaren Gerät große Fortschritte gemacht. Das Produkt namens Connexus Direct Data wird als Kommunikationsgerät beschrieben, das Patienten helfen kann, die weder sprechen noch tippen können. Die Technologie ist so vielversprechend, dass die FDA Paradromics die Auszeichnung „Breakthrough Device“ verliehen hat. Dieses Programm ermöglicht 32 Anwendungen eine beschleunigte Zulassung, da sie Patienten bei Behandlung und Diagnose helfen könnten.
Ein weiteres Unternehmen, das in die aufstrebende Branche der Brain-Computer-Schnittstellen (BCI) einsteigt, ist Synchron.
Diese Unternehmen bieten Produkte unterschiedlicher Größe, Gewicht und Leistungsfähigkeit an Halbleitern sowie chirurgische Methoden zu deren Implantation ins menschliche Gehirn an. Sie alle sind jedoch gleichermaßen optimistisch, was den zukünftigen Nutzen angeht, den diese Halbleiter Millionen von Menschen bringen könnten.
Laut baotintuc.vn
[Anzeige_2]
Quellenlink




































































































Kommentar (0)