Un gran equipo de investigadores de varias universidades y hospitales de Estados Unidos informan que han encontrado una forma de ayudar a reducir el riesgo de rechazo de trasplantes cuando se trasplantan riñones de cerdo a monos, según Medical Express.
Uno de los principales tratamientos para las personas con insuficiencia renal son los trasplantes de órganos de donantes. Sin embargo, los riñones de donantes son escasos. Por ello, los científicos buscan alternativas, una de las cuales es el uso de órganos animales.
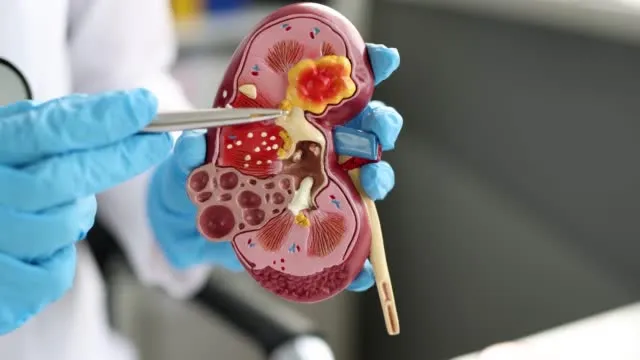
Uno de los tratamientos para las personas con insuficiencia renal es el trasplante de órganos de un donante.
En este nuevo esfuerzo, el equipo probó un enfoque novedoso: alterar los genes del animal donante para que sus órganos tuvieran menos probabilidades de ser rechazados.
El estudio, dirigido por el profesor Muhammad Mohiuddin, PhD, uno de los principales expertos en xenotrasplantes de la Facultad de Medicina de la Universidad de Maryland (EE.UU.), editó 69 genes de cerdo, incluidos 3 genes relacionados con el rechazo y 7 genes relacionados con la adición de genes humanos para promover el desarrollo de órganos sanos.
El equipo crió a los cerdos hasta la edad adulta y luego trasplantó riñones de 15 cerdos a 15 monos, a cada uno de los cuales también se le administraron medicamentos inmunosupresores para prevenir el rechazo.

Los científicos han alcanzado un hito importante en el programa de trasplante de riñones de cerdo a humanos.
Los resultados fueron los siguientes: 9 vivieron más de 2 meses; 5 vivieron más de 1 año; 1 vivió 2 años, según Medical Express.
Las pruebas demostraron que los órganos de los monos trasplantados funcionaban tan bien como los suyos propios.
Mientras tanto, los monos de control que no recibieron trasplantes de riñón vivieron menos de dos meses.
Los investigadores afirman que van por buen camino, pero necesitan realizar más pruebas. No obstante, el equipo confía en que su método podría algún día conducir a trasplantes seguros de órganos animales a humanos.
[anuncio_2]
Enlace de origen





![[Video] Muchas universidades bajan sus puntajes mínimos: Cuidado con los “puntajes bajos, estándares altos”](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/7/25/f91e64a5fa2c4a86a3b57997e5b263fc)























![[Foto] Firma de un acuerdo de cooperación entre ministerios, delegaciones y localidades de Vietnam y Senegal](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/7/24/6147c654b0ae4f2793188e982e272651)









































































Kommentar (0)