Le Pakistan enquête sur deux distributeurs de l'Avastin, médicament anticancéreux du laboratoire suisse Roche, après que 12 patients diabétiques ont perdu connaissance suite à des injections de ce médicament. L'Avastin est également commercialisé au Vietnam.
Au Vietnam, au 27 septembre, l'Administration des médicaments du Vietnam ( Ministère de la Santé ) n'avait reçu aucun rapport faisant état d'effets secondaires indésirables d'Avastin liés à une perte de vision chez les patients après utilisation d'Avastin.
L’Administration vietnamienne des médicaments a reçu un rapport du bureau de représentation de F. Hoffmann La Roche Ltd. concernant cet incident.
Au Pakistan, une douzaine de patients ont perdu la vue après avoir utilisé des injections fournies par le fournisseur illégal Genius Pharmaceutical Service. Le médicament était étiqueté « Inj. Avastin 1,25 mg/0,05 ml », laissant croire à tort qu'il s'agissait d'un produit Roche.
L’Avastin de Roche n’est pas autorisé pour un usage ophtalmique. La société Genius Pharmaceutical Service a fourni, dilué et reconditionné la dose de 1,25 mg/0,5 ml dans des conditions non hygiéniques et non conformes aux normes.
Les autorités pakistanaises enquêtent sur les causes de la contamination. Parmi les causes possibles figurent une stérilisation insuffisante, des flacons contaminés, des seringues non stérilisées et des écarts par rapport aux procédures opératoires standard lors de la dispensation.
Dans le même temps, le gouvernement pakistanais a demandé le rappel de 3 lots d'Avastin 100mg/ml (H352B11, B7266B07, B7266B20) de Roche et de tous les médicaments fournis par Genius Pharmaceutical Service.
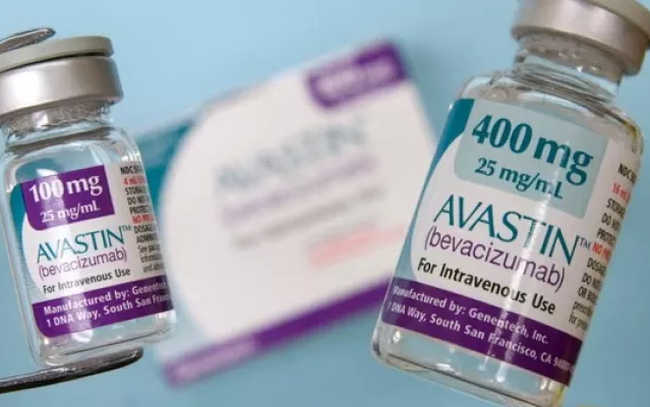
(Illustration : 24 News HD).
Au Vietnam, le médicament Avastin (dont le principe actif est le bévacizumab) a obtenu 4 autorisations de mise sur le marché, toutes encore valides.
Bevacizumab 100mg/4ml (boîte de 1 flacon x 4ml ; numéro d'enregistrement : 400410250123 (QLSP-1118- 18) ; fabricant : Roche Diagnostics GmbH, Allemagne).
Bevacizumab 400mg/16ml (boîte de 1 flacon x 16ml : numéro d'enregistrement : 400410250223 (QLSP-1119- 18) ; fabricant : Roche Diagnostics GmbH, Allemagne).
Bevacizumab 100 mg/4 ml (boîte de 1 flacon x 16 ml ; numéro d'enregistrement : QLSP-1010-17 ; fabricant : F. Hoffmann-La Roche Ltd., Suisse).
Bevacizumab 400 mg/16 ml (Boîte de 1 flacon x 16 ml ; numéro d'enregistrement : QLSP-1011-17 ; fabricant : F. Hoffmann-La Roche Ltd., Suisse).
Avastin est autorisé au Vietnam pour le traitement de certains cancers, notamment le cancer colorectal métastatique, le cancer du poumon non à petites cellules avancé, métastatique ou récidivant, le carcinome à cellules rénales avancé et/ou métastatique, le glioblastome/gliome malin (stade IV de l'OMS) ; le cancer épithélial de l'ovaire, des trompes de Fallope et le cancer primitif du péritoine.
En plus des avertissements généraux, la notice d'emballage approuvée par la FDA comprend un avertissement concernant le fait que ce produit n'est « pas destiné à un usage intravitréen ».
Plus précisément, le médicament peut provoquer des troubles visuels, et des cas individuels et des groupes d'effets indésirables oculaires graves ont été signalés après une injection intravitréenne, une voie d'administration non approuvée avec des mélanges d'Avastin provenant de flacons destinés à la perfusion intraveineuse chez les patients atteints de cancer.
Ces réactions comprennent l’infection intraoculaire, l’endophtalmie, l’uvéite, le décollement de la rétine, la déchirure de l’épithélium pigmentaire rétinien, le glaucome, l’hémorragie intraoculaire… Certains de ces événements ont entraîné des degrés variables de perte du champ visuel, y compris la cécité permanente .
Source


![[Photo] Lam Dong : Images des dégâts suite à la rupture présumée d'un lac à Tuy Phong](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/02/1762078736805_8e7f5424f473782d2162-5118-jpg.webp)

![[Photo] Le président Luong Cuong reçoit le secrétaire américain à la Guerre, Pete Hegseth.](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/02/1762089839868_ndo_br_1-jpg.webp)








































































































Comment (0)