Le commentaire ci-dessus a été fait par le Dr Nguyen Ngo Quang, directeur du Département des sciences, de la technologie et de la formation ( ministère de la Santé ) lors de l'atelier sur l'élaboration de normes nationales (TCVN) pour les cellules et les produits cellulaires utilisés dans la recherche, organisé par le ministère de la Santé le 6 octobre à l'Institut Pasteur de Ho Chi Minh-Ville.
Selon le Dr Nguyen Ngo Quang, le développement du domaine des cellules et des produits à base de cellules a récemment été mal maîtrisé. Si de nombreux scientifiques et centres de recherche ont investi massivement et respecté les réglementations pour garantir la qualité, de nombreux établissements médicaux et cliniques esthétiques, officiels ou non, ont profité de l'appellation « applications cellulaires » pour proposer des services à leurs clients sans aucune supervision, ce qui engendre de nombreux risques et conséquences.
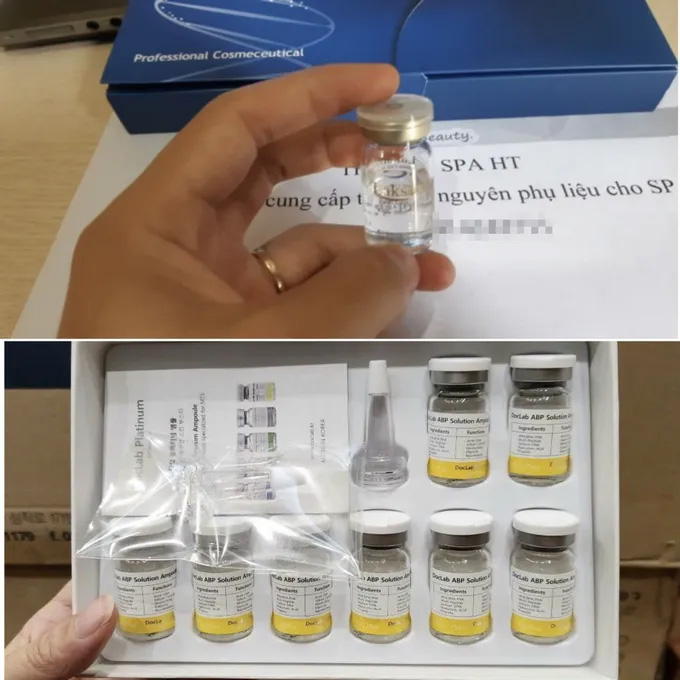
Le Dr Vo Thi Nhi Ha, chef du Département de la recherche scientifique et de la gestion du développement technologique au Département des sciences, de la technologie et de la formation du ministère de la Santé, a ajouté que le transport de cellules souches de l'étranger vers le Vietnam ou l'envoi de patients à l'étranger pour traitement présentent de nombreux risques juridiques et sécuritaires. Ces produits transportés ne sont pas conformes à la réglementation et n'ont pas été testés ni inspectés par les autorités compétentes, de sorte que leur qualité ne peut être garantie. Lors du transport et du stockage, ces produits ne respectent souvent pas les procédures techniques, ce qui altère facilement leurs propriétés biologiques et présente des risques pour les utilisateurs.

Le Dr Nguyen Ngo Quang a déclaré que sans outils de gestion spécifiques, les conséquences affecteraient avant tout la santé des personnes. Il a souligné que le contrôle de la qualité des cellules souches lors du processus d'application est une exigence obligatoire.

Selon le Dr Nguyen Ngo Quang, il s'agit d'un domaine technologique stratégique, il faut donc un corridor juridique clair, créant un mécanisme de développement mais toujours sous le contrôle de l'État.
Le Dr Nguyen Tri Thuc, vice-ministre de la Santé, a souligné : « Le premier ensemble de normes est très important et constitue la base du processus d'achèvement ultérieur pour servir la recherche et finalement le traitement, visant ainsi l'objectif commun d'assurer la santé des personnes, de normaliser les procédures de traitement et de recherche, d'éviter les erreurs ou les conséquences malheureuses dans le processus de demande ultérieur. »
En 2025, le ministère de la Santé publiera un ensemble de normes pour la qualité des cellules et des produits à base de cellules, initialement appliquées à la recherche et aux applications cliniques, puis étendues au traitement, afin de garantir le contrôle de la qualité et l'efficacité dans la pratique.
Source: https://cand.com.vn/y-te/nhieu-nguy-co-tu-viec-co-so-tham-my-su-dung-te-bao-goc-xach-tay-dieu-tri-benh-i783756/





























































































Comment (0)