Op 16 september meldde een vertegenwoordiger van de Drug Administration dat Novartis Vietnam vier klachten van gebruikers had ontvangen over vermoedelijk namaak oogdruppels, waaronder Tobrex, Maxitrol en TobraDex. Na verificatie werd bevestigd dat Tobrex 5 ml lotnummer VEE90A namaak was. Drie andere loten, waaronder Tobrex 5 ml (lot VEE98C), Maxitrol 5 ml (lot VFD09A) en TobraDex 5 ml (lot VHN07A), werden ook verdacht van namaak. Deze producten bleken allemaal buiten het officiële distributienetwerk van het bedrijf te circuleren. Een vertegenwoordiger van de Drug Administration meldde dat de bovengenoemde producten op grote schaal op de markt werden verkocht.
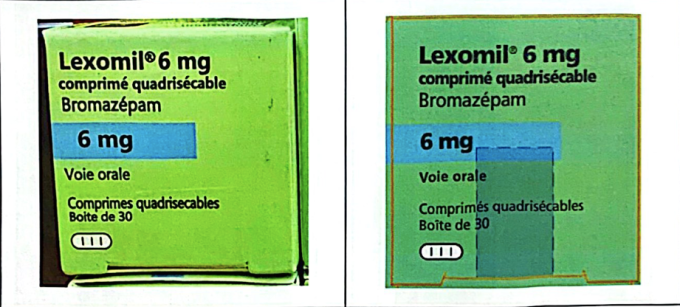
Het tweede geval betreft de slaappil Lexomil 6 mg met hoge dosering, eigendom van Cheplapharm Arzneimottel GmbH. De politie van Ho Chi Minhstad nam batchnummer F3193F01 in beslag, met een vervaldatum van december 2027, en bevestigde dat het om een namaakproduct ging. Deze batch was oorspronkelijk geproduceerd voor de Franse markt en niet geïmporteerd in Vietnam. Momenteel heeft Lexomil 6 mg geen binnenlands registratienummer, waardoor alle handel in en gebruik van dit product illegaal is.
Tot slot is er het medicijn Aclasta (met zoledroninezuur), dat wordt gebruikt bij de behandeling van osteoporose. Een apotheek in Kien Giang meldde een product met een productiedatum van augustus 2024 en een vervaldatum van juli 2027. Het geregistreerde bedrijf bevestigde dat deze partij medicijnen niet officieel was geïmporteerd en dat de verpakking afwijkingen vertoonde. Met name bij originele Aclasta-medicijnen die na mei 2024 zijn geproduceerd, is het Novartis-logo vervangen door het Sandoz-logo. Producten die na deze datum zijn geproduceerd, maar nog steeds het oude logo dragen, worden daarom vermoedelijk namaakproducten.
In deze situatie verzocht de Drug Administration de lokale gezondheidsdiensten om ziekenhuizen, apotheken en burgers te waarschuwen om de bovengenoemde medicijnen niet te verhandelen of te gebruiken. Er werden eenheden ingezet om met spoed de producten die aan de regelgeving voldeden te inspecteren, te monitoren en de herkomst ervan te traceren.
De beheersinstantie raadt mensen aan de informatie op de verpakking zorgvuldig te controleren en te vergelijken met de geregistreerde geneesmiddelengegevens op het portaal van de Drug Administration. Bij het detecteren van verdachte signalen dienen mensen onmiddellijk de autoriteiten te waarschuwen voor tijdige afhandeling.
PV (synthese)Bron: https://baohaiphong.vn/bo-y-te-canh-bao-khan-3-loai-thuoc-bi-nghi-lam-gia-521002.html



![[Foto] Lam Dong: Close-up van illegaal meer met kapotte muur](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/03/1762166057849_a5018a8dcbd5478b1ec4-jpg.webp)
![[Foto] Herfstbeurs 2025 en indrukwekkende records](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/03/1762180761230_ndo_br_tk-hcmt-15-jpg.webp)
![[Foto] Secretaris-generaal van Lam ontvangt de Singaporese ambassadeur Jaya Ratnam](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/03/1762171461424_a1-bnd-5309-9100-jpg.webp)

![[Foto] Premier Pham Minh Chinh ontvangt de voorzitter van de Japan-Vietnam Vriendschapsvereniging in de regio Kansai](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/11/03/1762176259003_ndo_br_dsc-9224-jpg.webp)







































































































Reactie (0)