По данным Управления по контролю за лекарственными средствами Вьетнама, из почти 320 иностранных лекарственных препаратов, вакцин и медицинских биологических продуктов, на которые в этот раз были выданы и продлены свидетельства о регистрации в сфере обращения, две трети иностранных лекарственных препаратов, вакцин и биологических продуктов были выданы заново; по остальным свидетельства о регистрации в сфере обращения были продлены.

Иллюстрация фото.
Из них 171 зарубежному препарату были выданы новые свидетельства о регистрации для обращения во Вьетнаме, при этом 164 зарубежным препаратам были выданы новые свидетельства о регистрации в течение 5 лет; 7 препаратам были выданы новые свидетельства о регистрации для обращения в течение 3 лет;
В настоящее время зарегистрировано 71 лекарственный препарат иностранного производства, из них 37 новых лекарственных препаратов выданы на 5 лет, 3 новых лекарственных препарата выданы на 3 года; 26 лекарственных препаратов иностранного производства продлены на 5 лет, 5 лекарственных препаратов иностранного производства продлены на 3 года; 69 вакцин и медицинских биологических препаратов продлены на срок от 3 до 5 лет.
Управление по контролю за лекарственными средствами Вьетнама требует, чтобы учреждения по производству и регистрации лекарственных препаратов, вакцин и биологических продуктов несли ответственность за: производство и поставку лекарственных препаратов во Вьетнам в соответствии с записями и документами, зарегистрированными в Министерстве здравоохранения , а также должны печатать или наносить на этикетку лекарственного препарата регистрационный номер, выданный Министерством здравоохранения.
Полностью соблюдать законы Вьетнама и постановления Министерства здравоохранения, касающиеся производства, импорта и обращения лекарственных средств во Вьетнаме. В случае каких-либо изменений в процессе обращения лекарственных средств в стране происхождения и во Вьетнаме, об этом необходимо немедленно сообщить в Департамент по контролю за лекарственными средствами Министерства здравоохранения.
Управление по контролю за лекарственными средствами также требует от организаций по производству и регистрации лекарственных средств обновлять стандарты качества лекарственных средств, этикетки и инструкции по применению лекарственных средств... в соответствии с нормативными актами; организации по регистрации лекарственных средств должны обеспечить поддержание условий ведения деятельности в течение срока действия регистрационного удостоверения на обращение лекарственных средств и их ингредиентов. В случае, если условия ведения деятельности больше не соответствуют требованиям, организация по регистрации обязана сменить организацию по регистрации в соответствии с нормативными актами в течение 30 дней с даты, когда организация по регистрации больше не соответствует требованиям...
Две недели назад Управление по контролю за лекарственными средствами Вьетнама также приняло решения о выдаче новых лицензий и продлении действия почти 500 лекарственных средств и фармацевтических ингредиентов отечественного и зарубежного производства, а также препаратов с доказанной биоэквивалентностью...
Источник: https://www.baogiaothong.vn/bo-y-te-tiep-tuc-cap-moi-gia-han-gan-320-thuoc-vaccine-va-sinh-pham-y-te-192241210134614784.htm









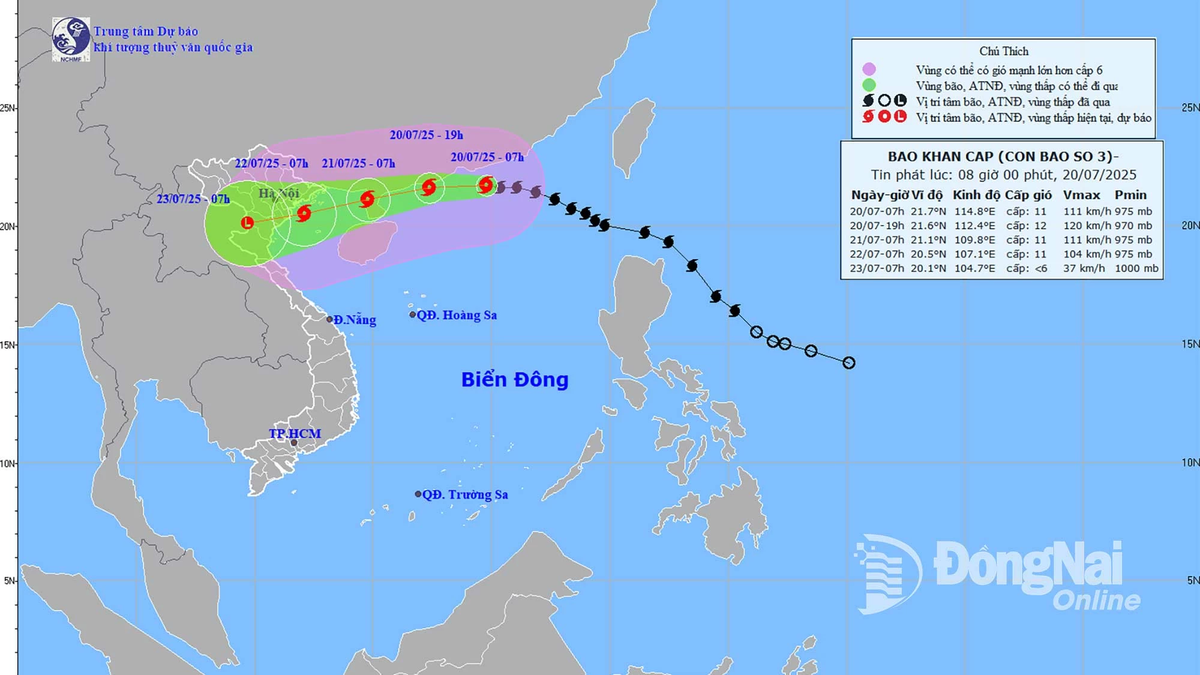



























































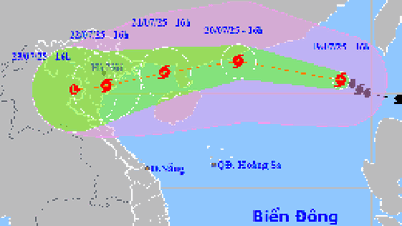




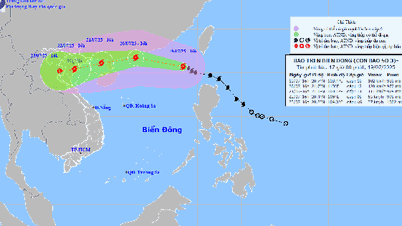
























Комментарий (0)