На дневном заседании 21 ноября 8-й сессии 15-го Национального собрания при согласии большинства делегатов Национальное собрание официально приняло Закон о внесении изменений и дополнений в ряд статей Закона о фармации.

На 8-й сессии 15-го Национального собрания 88,94% делегатов проголосовали «за» и был официально принят Закон о внесении изменений и дополнений в ряд статей Закона о фармации.
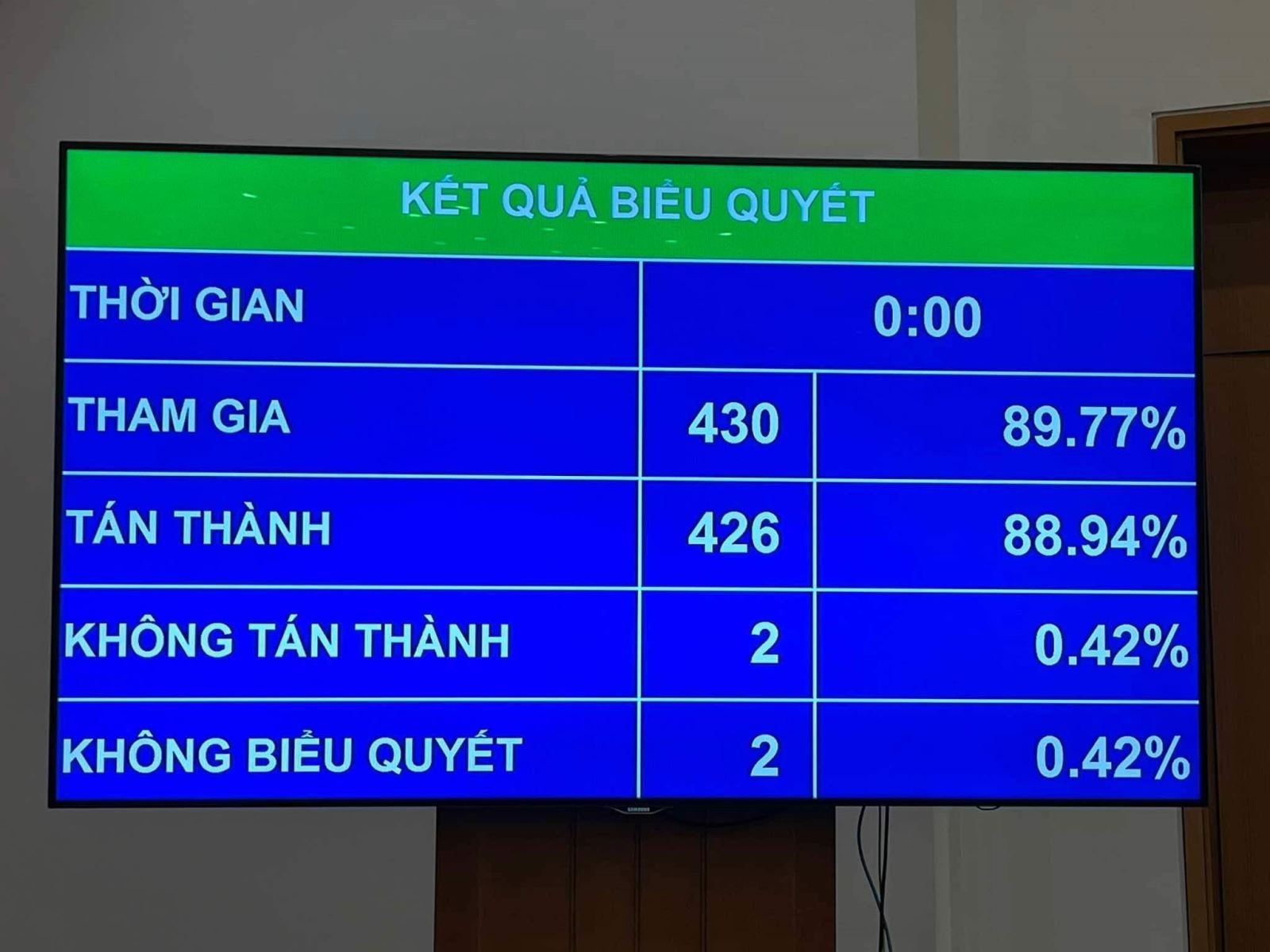
Прежде чем депутаты Национального собрания проголосовали за одобрение всего проекта Закона о внесении изменений и дополнений в ряд статей Закона о фармации, Национальное собрание проголосовало за одобрение двух положений Закона, в том числе:
Относительно пункта 23 статьи 1 «О правах и обязанностях организаций, организующих аптечные сети, и аптек, входящих в аптечную сеть». Результат голосования: 89,14% делегатов «за».
Проголосовать по пункту 30 статьи 1 о полномочиях, учете, процедурах, сроках выдачи и продления действия регистрационных удостоверений на обращение лекарственных средств и фармацевтических субстанций. Результат голосования: 86,22% делегатов «за».
Перед голосованием г-жа Нгуен Туи Ань, председатель Социального комитета Национальной ассамблеи, зачитала отчет о получении, разъяснении и доработке проекта Закона о внесении изменений и дополнений в ряд статей Закона о фармации.
В частности, в отношении государственной политики в области фармацевтики и развития фармацевтической промышленности (статьи 7 и 8 (измененные)), принимая во внимание мнения делегатов, Постоянный комитет Национального собрания поручил пересмотреть статью 7 (измененную) для обеспечения того, чтобы она отражала основное содержание принципов; добавив положения «Существует политика контроля количества свидетельств о регистрации обращения лекарственных средств для лекарственных средств с одинаковыми действующими веществами и лекарственными материалами в соответствии с социально-экономическими условиями в каждый период» в пункте 14 и «Приоритет инвестиций в развитие инфраструктуры информационных технологий, внедрение цифровой трансформации в фармацевтическую деятельность» в пункте 15. Однако для того, чтобы политика вступила в силу, особенно положения пунктов 8, 13, 14, Постоянный комитет Национального собрания хотел бы попросить разрешения все же поручить правительству подробно конкретизировать эту статью.
Что касается преференциальной политики и инвестиционной поддержки в промышленном развитии, то, основываясь на мнении большинства делегатов, Постоянный комитет Национального собрания согласился с правительством принять пункт 1 статьи 8 в соответствии с вариантом 1, который должен разрешить применение специальных стимулов и инвестиционной поддержки к новым проектам в фармацевтическом секторе с общим инвестиционным капиталом 3 000 млрд донгов или более, выплачивая не менее 1 000 млрд донгов в течение 3 лет с даты выдачи свидетельства о регистрации инвестиций или утверждения инвестиционной политики. В то же время, для обеспечения последовательности преференциальной политики и особой инвестиционной поддержки в фармацевтическом секторе Постоянный комитет Национального собрания обратился к правительству с просьбой обратить внимание на выражение налоговых льгот при внесении поправок в налоговое законодательство и смежные законы, включая проект Закона о налоге на прибыль предприятий (с изменениями).
Относительно деятельности аптечных сетей (статья 17а (дополненная); статьи 31, 32, 33, 36, 37 и 38 (измененные); статья 47а (дополненная); на основании мнений делегатов Постоянная комиссия Национальной ассамблеи рассмотрела и внесла изменения в положения об аптечных сетях; включая содержание поручения министру здравоохранения регулировать ротацию лиц, ответственных за фармацевтическую экспертизу между аптеками в сети, как указано в пункте g, пункте 2 статьи 47а (дополненная); регулирование ответственности аптек в сети по временному приостановлению деятельности в случае, если объект организации аптечной сети временно приостанавливает деятельность на 6 месяцев или более (пункт d, пункт 4 статьи 47а (дополненная), и по прекращению деятельности в случае прекращения деятельности объекта организации аптечной сети (пункт d, пункт 4 статьи 47а (дополненная).
О торговле лекарственными средствами и фармацевтическими ингредиентами посредством электронной коммерции (статьи 6, 32 и 42 (с изменениями)); На основании мнений делегатов, для обеспечения своевременного управления ситуациями, которые могут возникнуть на практике, в дополнение к правам и обязанностям, прописанным в законопроекте, Постоянный комитет Национального собрания добавил положение, предусматривающее, что фармацевтические предприятия, использующие методы электронной коммерции, должны соблюдать постановления правительства об оптовой торговле лекарственными средствами, фармацевтическими ингредиентами и розничной торговле лекарственными средствами с использованием методов электронной коммерции, изложенные в пункте h) пункта 4 статьи 42 (измененной). Одновременно обобщить положения о правах и обязанностях субъектов фармацевтической деятельности при осуществлении деятельности методом электронной коммерции в пункте 4 статьи 42 (с изменениями и дополнениями).
Что касается выдачи, продления, изменения и дополнения свидетельств о регистрации оборота лекарственных средств (статья 56 (измененная)); реализуя принцип инновационного мышления в законодательном строительстве, Постоянный комитет Национального собрания пересмотрел измененное содержание статьи 56 в направлении не конкретного регулирования в Законе, а поручения министру здравоохранения определить досье и процедуры для выдачи, продления, изменения и дополнения свидетельств о регистрации оборота лекарственных средств и фармацевтических ингредиентов в статье 56.
Кроме того, принимая во внимание мнения делегатов, предлагающих изучить и дополнить нормативные акты, ограничивающие выдачу новых свидетельств о регистрации лекарственных средств с дублированием, ограничивающие использование политики «резервирования» регистрации для лицензий на обращение из-за низких лицензионных сборов, в ближайшем будущем пункт 7 статьи 56 (измененной) предусматривает, что действие свидетельств о регистрации лекарственных средств, не находящихся на рынке в течение 5 лет, не будет продлеваться. В то же время пункт 14 статьи 7 (измененной) устанавливает, что государство осуществляет политику контроля за количеством свидетельств о регистрации лекарственных средств в обороте для лекарственных средств с одинаковым действующим веществом и лекарственными травами и поручает Правительству разработать подробные правила.
Относительно управления ценами на лекарственные средства (объяснение терминов в пунктах 44, 45, 46 и 47, статья 2 (измененная); статьи 107, 109, 110, 112 и 113 (измененные); отмена статьи 114): Приняв во внимание мнения делегатов, Постоянный комитет Национального собрания рассмотрел и согласился с предложением правительства о мерах регулирования для объявления оптовых цен, которые, как ожидается, будут применяться к рецептурным препаратам. Это специфическая мера управления ценами на лекарственные средства, поскольку рецептурные препараты занимают большую долю рынка, широко используются в медицинских учреждениях и пациенты должны приобретать их по рецепту врача. Кроме того, Министерство здравоохранения рекомендует фармацевтическим предприятиям ограничить рост цен на лекарства на каждом уровне, на промежуточном уровне и повысить цены при достижении конечными потребителями. При этом сохранить действующие нормативы предельной розничной торговой наценки на лекарственные препараты, реализуемые в организациях розничной торговли лекарственными средствами на территориях лечебно-профилактических учреждений.
Что касается предложения делегатов о мерах по декларированию цен, то, поскольку это содержание реализуется в соответствии с законом о ценах, Постоянный комитет Национального собрания предложил правительству пересмотреть руководящие документы и подробные положения Закона о ценах 2023 года, чтобы дополнить положения о критериях отбора списка учреждений, обязанных декларировать цены, обеспечив последовательное и прозрачное внедрение на местах; В то же время внимательно следить за процессом внедрения, своевременно выявлять трудности и проблемы для решения; Министерству здравоохранения поручено периодически обновлять Перечень основных лекарственных средств для обеспечения полного соответствия положениям закона о ценах.
Относительно положений о реализации (статья 3): В ответ на мнения делегатов Постоянная комиссия Национального собрания пересмотрела положения о реализации и переходные положения, указанные в статье 3 законопроекта. Соответственно, Закон вступает в силу с 1 июля 2025 года (пункт 1 статьи 3) и применяется только с 1 января 2025 года к положениям о продлении срока действия регистрационного удостоверения на обращение лекарственных средств и фармацевтических субстанций, а также к положениям об оптовой торговле лекарственными средствами и фармацевтическими субстанциями предприятиями по производству, импорту и оптовой торговле лекарственными средствами (пункт 2 статьи 3) для немедленного преодоления трудностей в фармацевтическом бизнесе.
Мнения депутатов Национального собрания были серьезно изучены, полностью учтены, и законопроект был пересмотрен по таким конкретным положениям, как: (i) понятия «безрецептурные лекарственные средства» и «высокотехнологичные лекарственные средства»; (ii) установить, что лицо, ответственное за фармацевтическую экспертизу в организации аптечной сети, должно иметь диплом фармацевта и 2 года профессиональной практики в соответствующем аптечном учреждении; (iii) обеспечить прозрачность и последовательность в регулировании прав производственных предприятий, экспортно-импортных предприятий, предприятий оптовой торговли лекарственными средствами и фармацевтическими ингредиентами, а также фармацевтических предприятий с иностранными инвестициями; (iv) разрешить медицинским учреждениям по обследованию и лечению импортировать лекарственные препараты, не имеющие свидетельства о регистрации обращения во Вьетнаме, для удовлетворения особых потребностей в лечении пациентов учреждения в соответствии с пунктом i, пунктом 2, статьей 60 и поручить правительству подробно определить передачу лекарственных препаратов в пункте d, пунктом 7, статьей 60; (v) Поручить министру здравоохранения определить форму и метод предоставления информации о лекарственных средствах (вместо правительства, как это делается в настоящее время) и пересмотреть формулировки, стиль и законодательные приемы в большинстве статей и положений законопроекта.
Пересмотренный проект Закона состоит из 3 статей, из которых статья 1 вносит изменения в 50 статей, отменяет 2 пункта, 2 предложения и 1 статью действующего Закона об аптеках, а также добавляет 3 новые статьи; Статья 2 вносит изменения и дополнения в Приложение № 01, изданное вместе с Законом о ценах № 16/2023/QH15; Статья 3 об условиях реализации.
Содержание приема, объяснения и корректировки подробно представлено в отчете № 1062, включающем 6 основных пунктов, 10 специальных пунктов и прочее содержание.
По сравнению с действующим Законом законопроект содержит 7 основных новых групп пунктов, а именно:
Государственная политика в отношении фармацевтики продолжает совершенствоваться, институционализируя взгляды партии с целью превращения вьетнамской фармацевтической промышленности в передовую отрасль. Соответственно, законопроект добавляет ряд более инновационных положений по сравнению с Законом «Об фармации» 2016 года для привлечения инвестиций и дальнейшего содействия исследованиям и разработкам в области производства лекарственных средств и фармацевтических субстанций, таких как льготная политика в отношении административных процедур при выдаче свидетельств о регистрации в обращении и лицензий на импорт; политика применения преференциальных механизмов и поддержки из фондов поддержки научной и технологической деятельности в области исследований, разработок, клинических испытаний, передачи технологий, производства лекарственных препаратов и фармацевтических ингредиентов; Политика поддержания и снижения цен на отдельные группы лекарственных средств с передачей технологии производства; политика цифровой трансформации в фармацевтической деятельности; Определить масштаб проектов в фармацевтическом секторе, которые имеют право на льготы и особую инвестиционную поддержку, и поручить правительству разработать подробные правила для обеспечения осуществимости и реализации государственной политики в области фармацевтики и развития фармацевтической промышленности.
Создание правового коридора для новых форм и методов ведения бизнеса, а именно: (i) регулирование создания аптечной сети как отдельного вида фармацевтического бизнеса, условий ведения бизнеса, прав и обязанностей учреждения аптечной сети, аптек в аптечной сети, в частности права ротации лекарственных препаратов и права ротации лиц, ответственных за фармацевтическую экспертизу, между аптеками в аптечной сети; (ii) правила торговли лекарственными средствами и фармацевтическими ингредиентами посредством электронной коммерции, в частности, дополняющие правила об электронных средствах, типах лекарственных средств и фармацевтических ингредиентов, разрешенных к торговле посредством электронной коммерции; дополнить права и обязанности предприятий фармацевтической отрасли в соответствии с настоящим методом.
Определить в Законе права и обязанности предприятий фармацевтической отрасли с иностранными инвестициями для обеспечения гласности и прозрачности государственного управления.
Расширение прав производственных предприятий, предприятий по экспорту и импорту, а также предприятий оптовой торговли лекарственными средствами и фармацевтическими ингредиентами для осуществления прямых продаж ряду медицинских учреждений, учреждений по реабилитации наркозависимых, испытательных центров, научно-исследовательских и учебных заведений и ряду других учреждений; Разрешить медицинским учреждениям, проводящим обследование и лечение, импортировать лекарственные препараты для удовлетворения особых потребностей пациентов в медицинских учреждениях, проводящих обследование и лечение.
Продвигать реформу административных процедур в сфере регистрации оборота лекарственных средств и фармацевтических субстанций в направлении классификации лекарственных средств и фармацевтических субстанций на основе различных уровней свойств лекарственных средств, а также оборота для корректировки записей, процедур, сроков выдачи, продления, изменения и дополнения свидетельств о регистрации оборота лекарственных средств и фармацевтических субстанций соответствующим образом, чтобы расширить возможности раннего доступа населения к лекарственным средствам, при этом обеспечивая эффективность государственного управления, контроля качества, безопасности и эффективности лекарственных средств; Дополнить правила, ограничивающие выдачу дублирующих регистрационных номеров обращения. В то же время существуют специальные правила учета и процедуры регистрации лекарственных средств, их ингредиентов, тестирования на наркотики и торговли наркотиками в целом, которые отвечают требованиям национальной обороны, безопасности, стихийных бедствий, катастроф и эпидемий.
Отменить процедуру подтверждения содержания информации о лекарственных средствах. Усилить децентрализацию, делегирование полномочий, повысить роль Департамента здравоохранения в отзыве и оперативном обращении с лекарственными средствами, не соответствующими качеству в сфере управления, обеспечивая безопасное и эффективное использование лекарственных средств.
Предусмотреть меры по управлению ценами для соблюдения Закона о ценах, а также конкретные меры по управлению ценами на лекарственные средства: объявлять и повторно объявлять ожидаемые оптовые цены на рецептурные лекарственные средства, гарантируя, что оптовая продажа лекарств через посреднические уровни не превысит объявленные ожидаемые оптовые цены.
ВНА
Источник: https://baohanam.com.vn/chinh-tri/nguoi-dai-bieu-nhan-dan/quoc-hoi-chinh-thuc-thong-qua-luat-duoc-sua-doi-140545.html




![[Фото] Определение пар в командном полуфинале Национального чемпионата по настольному теннису газеты Nhan Dan](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/21/eacbf7ae6a59497e9ae5da8e63d227bf)
![[Фото] Премьер-министр Фам Минь Чинь принимает раввина Йоава Бен Цура, министра труда Израиля](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/21/511bf6664512413ca5a275cbf3fb2f65)

![[Фото] Премьер-министр Фам Минь Чинь принимает участие в церемонии закладки фундамента проекта Trump International Hung Yen](https://vphoto.vietnam.vn/thumb/1200x675/vietnam/resource/IMAGE/2025/5/21/ca84b87a74da4cddb2992a86966284cf)




















































































Комментарий (0)